
【题目】室温时,向20mL 0.1mol/L的醋酸溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是
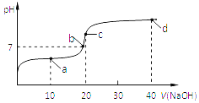
A. a点时:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-)
B. b点时:c(Na+) = c(CH3COO-)
C. c点时:c(OH-) =c(CH3COOH) + c(H+)
D. d点时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
【答案】D
【解析】
A.a点时醋酸过量,溶液为CH3COOH和CH3COONa的混合物,溶液呈酸性,醋酸根离子的水解程度小于醋酸的电离程度,则c(CH3COO-)>c(CH3COOH),但醋酸的电离程度较小,因此c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-),故A正确;B.溶液中存在电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),b点时溶液的pH=7,呈中性,则c(H+)=c(OH-),根据电荷守恒可知c(Na+)=c(CH3COO-),故B正确;C.c点时,氢氧化钠与醋酸恰好反应生成醋酸钠溶液,醋酸钠溶液中存在电荷守恒:①c(Na+)+c(H+)=c(CH3COO-)+c(OH-),也存在物料守恒:②c(Na+)=c(CH3COO-)+c(CH3COOH),将②带入①可得:c(OH-)=c(CH3COOH)+c(H+),故C正确;D.d点为等物质的量的NaOH和CH3COONa的混合物,溶液呈碱性,由于CH3COO-存在微弱的水解,则:c(Na+)>c(OH-)>c(CH3COO-)>c(H+),故D错误;故选D。


科目:高中化学 来源: 题型:
【题目】完成下列化学用语:
(1)画出 O2﹣结构示意图:_____,某种核素质量数 37,中子数 20,其原子符号:_____
(2)写出实验室制氯气的化学方程式:______________________
(3)工厂里常用浓氨水来检验氯气管道是否泄漏,其原理为:8NH3+3Cl2=6NH4Cl+N2,请用双线桥表示其电子转移的方向和数目__________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.反应CaCO3(s)=CaO(s)+CO2(g),在常温下不能自发进行,则该反应的△H<0
B.0.lmol·L一1CH3COOH溶液加水稀释后,溶液中 的值减小
的值减小
C.铅蓄电池在放电过程中,负极质量增加,正极质量减少
D.锅炉中沉积的CaSO4和BaSO4都可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线如图所示,AgCl,AgBr,AgI的Ksp依次减小。已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX—pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系。下列说法错误的是
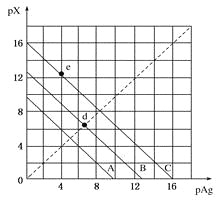
A.e点表示由过量的KI与AgNO3反应产生AgI沉淀
B.A线是AgCl的溶解平衡曲线,C线是AgI的溶解平衡曲线
C.d点是在水中加入足量的AgBr形成的饱和溶液
D.坐标点(8,4)形成的溶液是AgCl的不饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是
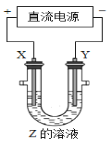
A. 氯碱工业中,X、Y均为石墨,Y附近能得到氢氧化钠
B. 铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4
C. 电镀工业中,X是待镀金属,Y是镀层金属
D. 外加电流的阴极保护法中,X是待保护金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,同温度下涉及如下反应:
①2NO(g)+Cl2(g)![]() 2ClNO(g) ΔH1<0,平衡常数为K1;
2ClNO(g) ΔH1<0,平衡常数为K1;
②2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) ΔH2<0,平衡常数为K2。
NaNO3(s)+ClNO(g) ΔH2<0,平衡常数为K2。
(1)4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) ΔH3,平衡常数K=___________________(用K1、K2表示)。ΔH3=___________(用ΔH1、ΔH2表示)。
2NaNO3(s)+2NO(g)+Cl2(g) ΔH3,平衡常数K=___________________(用K1、K2表示)。ΔH3=___________(用ΔH1、ΔH2表示)。
(2)为研究不同条件对反应①的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min时反应①达到平衡。测得10 min内v(ClNO)=7.5×10-3mol·L-1·min-1,则平衡后n(Cl2)=__________mol,NO的转化率α1=___________。其他条件保持不变,反应①在恒压条件下进行,平衡时NO的转化率为α2,α1____α2(填“>”“<”或“=”),平衡常数K1______________(填“增大”“减小”或“不变”)。若要使K1减小,可采用的措施是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,水的离子积为Kw,该温度下将a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,要使混合液呈中性,必要的条件是
A. 混合液中c(H+)=![]() B. 混合液的pH=7
B. 混合液的pH=7
C. a=b D. 混合液中c(B+)=c(A-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置中,M为金属活动性顺序表中位于氢之前的金属,N为石墨棒,下列关于此装置的叙述中不正确的是

A.N上有气体放出
B.M为负极,N为正极
C.是化学能转变为电能的装置
D.导线中有电流通过,电流方向是由M到N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100mL的混合液中,硝酸和硫酸的物质的量浓度分别是0.3mol/L、0.15mol/L,向该混合液中加入2.56g铜粉,加热,待充分反应后,所得溶液中铜离子的物质的量浓度是
A. 0.15mol/L B. 0.225mol/L C. 0.30mol/L D. 0.45mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com