
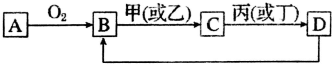
分析 A是单质,与氧气反应生成B为氧化物,甲、乙、丙、丁四种化合物间除甲与丁、丙与乙外,两两均能发生中和反应,为酸与碱的反应,甲与丁为同类物质,丙与乙为同类物质,氧化物B能与酸或碱反应生成C,D是A单质所含元素的最高价氧化物的水化物,结合转化关系,可推知B为Al2O3,则A为Al、C为Al(OH)3,
(1)氧化铝可以制备Al(或作耐火材料)等;
(2)B转化生成C为氧化铝与强碱或强酸的反应;
(3)若C的溶液显酸性,则C为铝盐,溶液中铝离子水解生成氢氧化铝胶体,可以净水;
(4)若C为钠盐,则甲为NaOH,C为NaAlO2,根据 AlO2-+H2O+H+=Al(OH)3↓、Al(OH)3+3H+=Al3++3H2O计算生成氢氧化铝的物质的量.
解答 解:A是单质,与氧气反应生成B为氧化物,甲、乙、丙、丁四种化合物间除甲与丁、丙与乙外,两两均能发生中和反应,为酸与碱的反应,甲与丁为同类物质,丙与乙为同类物质,氧化物B能与酸或碱反应生成C,D是A单质所含元素的最高价氧化物的水化物,结合转化关系,可推知B为Al2O3,则A为Al、C为Al(OH)3,则:
(1)Al2O3在工业上制备Al(或作耐火材料),A物质在工业生产中的一种用途是铝热反应.可以利用放出的热量焊接钢轨,反应的化学方程式为:2Al+Fe3O2$\frac{\underline{\;高温\;}}{\;}$2AlO2-+2Fe,
故答案为:工业上制备Al(或作耐火材料); 2Al+Fe3O2$\frac{\underline{\;高温\;}}{\;}$2AlO2-+2Fe;
(2)B转化生成C为氧化铝与强碱或强酸的反应,反应离子方程式为:Al2O3+6H+=2Al3++3H2O 或Al2O3+2OH-=AlO2-+H2O,
故答案为:Al2O3+6H+=2Al3++3H2O 或Al2O3+2OH-=AlO2-+H2O;
(3)若C的溶液显酸性,则C为铝盐,溶液中铝离子水解Al3++3H2O?Al(OH)3(胶体)+3H+,生成氢氧化铝胶体,可以净水,
故答案为:Al3++3H2O?Al(OH)3(胶体)+3H+;
(4)若C为钠盐,则甲为NaOH,C为NaAlO2,1L n mol•L-1的盐酸中n(HCl)=n mol,由于n(NaAlO2):n(HCl)=1:2,故按AlO2-+H2O+H+=Al(OH)3↓反应,盐酸有剩余,能部分溶解氢氧化铝,则:
AlO2-+H2O+H+=Al(OH)3↓
m mol m mol m mol
剩余n(H+)=n mol-m mol=(n-m)mol
Al(OH)3+3H+=Al3++3H2O
$\frac{n-m}{3}$mol (n-m)mol
故得到氢氧化铝沉淀为:m mol-$\frac{n-m}{3}$mol=$\frac{4m-n}{3}$mol,
故答案为:$\frac{4m-n}{3}$;
点评 本题考查无机物推断、盐类水解、根据方程式计算、原电池等,B是氧化物且能与酸、碱反应是推断突破口,题目难度中等.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| 碱 | 酸 | 盐 | 酸性氧化物 | |
| A | 纯碱 | 盐酸 | 胆矾 | 二氧化硫 |
| B | 烧碱 | 硫酸 | 食盐 | 一氧化碳 |
| C | 苛性钠 | 醋酸 | 石灰石 | 水 |
| D | 苛性钠 | 碳酸 | 碳酸镁 | 三氧化碳 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
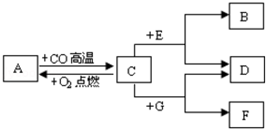 现有A、B、C、D、E、F、G七种物质,C、F是最常见的金属,B是气体单质,D为FeSO4溶液,G为CuSO4溶液,它们之间存在如图所示关系:
现有A、B、C、D、E、F、G七种物质,C、F是最常见的金属,B是气体单质,D为FeSO4溶液,G为CuSO4溶液,它们之间存在如图所示关系:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,22.4L的C6H14所含分子数为NA | |
| B. | 相同质量的H2和Cl2相比,H2的分子数多 | |
| C. | 2.3g金属Na变成Na+时失去的电子数目为0.1NA | |
| D. | 在1L0.1mol/L的HAc溶液中,所含Ac-与HAc之和为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在 | |
| B. | 向氯水中滴加石蕊试液,溶液先变红后褪色,说明溶液中有盐酸和次氯酸 | |
| C. | 加入盐酸酸化,再加入硝酸银溶液产生白色沉淀,说明氯水中有Cl-存在 | |
| D. | 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 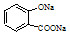 溶液通入少量CO2: 溶液通入少量CO2: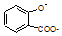 +CO2+H2O═ +CO2+H2O═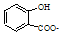 +HCO3- +HCO3- | |
| B. | 水电离产生的c(H+)=10-12mol•L-1的溶液中:Na+、Fe2+、SO42-、NO3-可能会大量共存 | |
| C. | 少量SO2通入NaClO溶液中:SO2+ClO-+OH-=SO42-+Cl-+H+ | |
| D. | 5.6 g Fe与200 mL 2.0 mol/L HNO3溶液:3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com