
分析 用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,锌为负极,电极反应为:Zn-2e-=Zn2+;铜为正极,电极反应为2H++2e-=H2↑;根据两极转移电子数目相等计算.
解答 解:用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,
锌为负极,电极反应为:Zn-2e-=Zn2+,
铜为正极,电极反应为2H++2e-=H2↑,
锌片的质量减少了3.25克,则物质的量为$\frac{3.25g}{65g/mol}$=0.05mol,
转移的电子的物质的量为n(e-)=2n(Zn)=2n(H2)=2×0.05mol=0.1mol,
则:V(H2)=0.05mol×22.4L/mol=1.12L,
故答案为:1.12L;0.1.
点评 本题考查原电池的工作原理,题目难度不大,注意两极电极反应转移的电子数目相等.


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成物所具有的总能量高于反应物所具有的总能量 | |
| B. | 反应物所具有的总能量高于生成物所具有的总能量 | |
| C. | 断开1 mol H-H键和1 mol Cl-Cl键所吸收的总能量大于形成2mol H-Cl键所放出的能量 | |
| D. | 该反应中,化学能只转变为热能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的二氯代物只有1种 | B. | 甲烷分子中4个C-H键的长度相同 | ||
| C. | 甲烷的一氯代物只有1种 | D. | 甲烷分子中4个C-H键的强度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
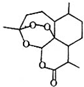 屠呦呦1971年发现、分离、提纯并用于治疟新药“青蒿素”,拯救了数千万人的生命.青蒿素分子结构如图.下列说法错误的是( )
屠呦呦1971年发现、分离、提纯并用于治疟新药“青蒿素”,拯救了数千万人的生命.青蒿素分子结构如图.下列说法错误的是( )| A. | 青蒿素的分子式为C15H22O5 | B. | 青蒿素是芳香族化合物 | ||
| C. | 青蒿素可以发生水解反应 | D. | 青蒿素不能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com