
【题目】某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。

(实验一)碘含量的测定。取0.0100mol/L的AgNO3标准溶液装入滴定管,取100.00mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E)反映溶液中c(I-)的变化,部分数据如下表:
V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
回答下列问题:
(1)实验中“灼烧”是在__(填仪器名称)中完成的。
(2)用文字具体描述“定容”过程:__
(3)根据表中数据判断滴定终点时用去AgNO3溶液的体积为__mL,计算得海带中碘的质量百分含量为__%。
(实验二)碘的制取。另制海带浸取原液,甲、乙两种实验方案如下:

已知:3I2+6NaOH=5NaI+NaIO3+3H2O。
(4)“适量O2”中能代替O2的最佳物质对应的电子式为__
(5)若要测定“I2+水溶液”中碘的含量,可以选择__作指示剂,用Na2S2O3溶液滴定,滴定终点的现象是__。
(6)若得到“I2+水溶液”时加入硫酸溶液过多,用Na2S2O3溶液滴定时会产生明显的误差,产生此误差的原因为__(用离子方程式表示)。
【答案】坩埚 容量瓶中加蒸馏水至刻度线下1~2cm处,改用胶头滴管滴加蒸馏水至凹液面最低处与刻度线相切 20.00 0.635 ![]() 淀粉溶液 滴加最后一滴Na2S2O3溶液时,锥形瓶内的溶液由蓝色变为无色,且半分钟内不变色 2H++
淀粉溶液 滴加最后一滴Na2S2O3溶液时,锥形瓶内的溶液由蓝色变为无色,且半分钟内不变色 2H++![]() =S↓+SO2↑+H2O
=S↓+SO2↑+H2O
【解析】
本实验为探究海带中碘含量的测定和碘的制取实验,碘含量的测定实验中,将干海带在坩埚中灼烧后加水溶解、转移,煮沸、过滤、转移到定容容器中得到含有I-的海带浸取原液,用AgNO3的标准溶液进行滴定,根据关系式法求得海带中碘的质量百分含量;碘的制取实验中,向海带浸取原液中通入适量的O2将I-氧化为I2,再用CCl4萃取分液后得到含有I2的CCl4溶液,经蒸馏(方案甲)可得到纯碘,或加入NaOH溶液,发生反应3I2+6NaOH=5NaI+NaIO3+3H2O,分液后向上层液体中加入H2SO4,I-和![]() 发生归中反应得到I2+水溶液,再经一系列步骤得到纯碘,据此分析解答问题。
发生归中反应得到I2+水溶液,再经一系列步骤得到纯碘,据此分析解答问题。
【实验一】
(1)实验中“灼烧”一般在坩埚中进行,则进行灼烧的仪器名称为坩埚;
(2)根据配制一定物质的量浓度溶液定容操作为:继续向容量瓶中加蒸馏水至刻度线下1~2cm处,改用胶头滴管滴加蒸馏水至凹液面最低处与刻度线相切;
(3)利用硝酸银溶液滴定碘离子,根据表格中电动势的变化可得,当加入硝酸银溶液的体积为19.98~20.02mL之间时,电动势发生突变,则滴定终点时用去AgNO3溶液的体积为20.00mL,则碘的百分含量为![]() ×100%=0.635%;
×100%=0.635%;
【实验二】
(4)向含有碘离子的海带浸取原液通入适量氧气将碘离子氧化为碘单质,可用其他氧化剂来氧化碘离子且不引入新的杂质,可以选用双氧水来作氧化剂氧化碘离子,双氧水的电子式为![]() ;
;
(5)碘单质遇淀粉变蓝,则滴定操作可用淀粉溶液作指示剂,滴定终点时,碘单质被Na2S2O3溶液全部转化为碘离子,现象为:滴加最后一滴Na2S2O3溶液时,锥形瓶内的溶液由蓝色变为无色,且半分钟内不变色;
(6)酸性条件下,Na2S2O3自身会发生歧化反应,离子反应方程式为:2H++![]() =S↓+SO2↑+H2O。
=S↓+SO2↑+H2O。


科目:高中化学 来源: 题型:
【题目】在一定条件下,体积不变的密闭容器中,发生可逆反应2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0,达到平衡后,当单独改变下列条件后,有关叙述正确的是
2SO3(g) ΔH<0,达到平衡后,当单独改变下列条件后,有关叙述正确的是
A. 增大压强,平衡正向移动,此反应的ΔH仍保持不变
B. 增大O2浓度,SO2的平衡转化率减小
C. 降低温度,化学平衡常数减小
D. 升高温度,SO2的转化率一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱和小苏打都是重要的化工原料,在生产和生活中有着广泛的应用。
(1)用洁净的铂丝蘸取Na2CO3溶液置于酒精灯火焰上灼烧,火焰呈__________色。
(2)实验室中需0.2mol/L的Na2CO3溶液950mL,配制时应选用容量瓶的规格和称取Na2CO3的质量分别是__________。
A.1000mL;21.2g B.950mL;20.14g C.500mL;21.2g D.500mL;10.6g
(3)若加热10.00g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了2.48g,则原混合物中碳酸钠的质量分数为______。
(4)某同学为确定一包可能由碳酸钠和碳酸氢钠组成的白色混合物的成分,他取少量该白色物质溶于水,并向所得溶液中加入适量澄清石灰水,产生白色沉淀,据此该同学认为有碳酸钠。你是否同意该同学的观点,请你用适当的化学方程式阐述你的观点________。
(5)取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如图所示,试回答下列问题:

①曲线A表明,原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为_______mL。
②曲线B表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是________,其物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家合成了一种新的化合物,其结构式如图所示。该物质中 W、X、Y、Z、M是短周期中常见元素,且原子序数依次增大;已知M元素原子核外电子总数是Y元素原子核外 电子总数的两倍。下列说法中错误的是
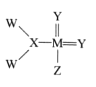
A.由X和Y两种元素形成的化合物有多种
B.W和Z元素位于周期表中同一主族
C.元素的非金属性强弱顺序为:Z>Y>X
D.Y、M元素的气态氢化物沸点高低为:Y>M
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯是一种重要的有机化工原料,用于制丙烯腈、环氧丙烷、丙酮等。回答下列问题:
(1)已知:
I.C3H8(g)![]() C3H6(g)+H2(g) △H1=+124kJ/mol
C3H6(g)+H2(g) △H1=+124kJ/mol
II.2H2(g)+O2(g)=2H2O(g) △H2=-484kJ/mol
则丙烷氧化脱氢制丙烯反应2C3H8(g)+O2(g)![]() 2C3H6(g)+2H2O(g)的△H为_________kJ/mol。
2C3H6(g)+2H2O(g)的△H为_________kJ/mol。
(2)我国学者结合实验与计算机模拟结果,研究了丙烷在六方氮化硼催化剂表面氧化脱氢制丙烯的反应历程如图所示,其中吸附在催化剂表面的物种用*标注。
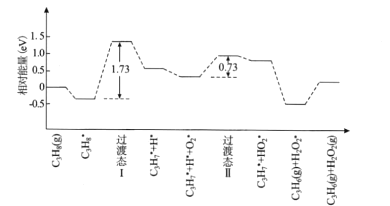
①该反应历程中决速步骤的能垒(活化能)为_________eV,该步骤的化学方程式为________
②请补充该历程之后可能发生的化学反应方程式_____________
(3)已知丙烷氧化脱氢容易发生副反应:2C3H8(g)+O2(g)![]() 3C2H4(g)+2H2O(g)如图所示是丙烷氧化脱氢制丙烯反应达到平衡时丙烷转化率与丙烯选择性随温度变化的曲线[丙烯的选择性=n=
3C2H4(g)+2H2O(g)如图所示是丙烷氧化脱氢制丙烯反应达到平衡时丙烷转化率与丙烯选择性随温度变化的曲线[丙烯的选择性=n=![]() ×100%]
×100%]
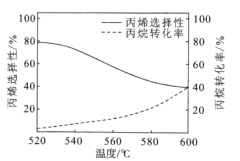
①丙烯的选择性随着温度的升高而降低的可能原因有_________
②在反应温度为600℃,将C3H8与O2以体积比为1:1充入刚性容器中,达到平衡时,丙烷的转化率为40%,丙烯的选择性也为40%,体系总压强为pkPa,则氧气的转化率![]() (O2)=______________丙烯的分压p(C3H8)=____________(结果保留2位有效数字)。
(O2)=______________丙烯的分压p(C3H8)=____________(结果保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M是合成抗病毒药品洛匹那韦的一种重要中间体。其合成路线如下(其中Ph表示苯基):
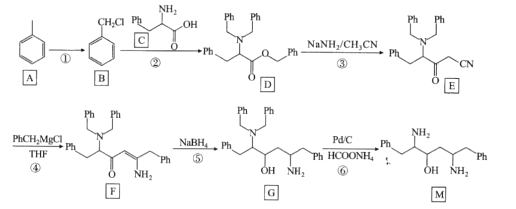
回答下列问题:
(1)物质A的化学名称是_______________
(2)反应①所需的试剂和条件是 ______________;反应⑤所属的反应类型为__________________
(3)F中含氧官能团的名称是_______________
(4)反应②的化学反应方程式为______________
(5)有机物X是C的同分异构体,写出满足下列条件的X结构简式为_______________
①苯环上有三个取代基
②分子结构中含有硝基
③核磁共振氢谱有4组峰,峰面积之比为6:2:2:1
(6)写出以![]() 和CH3CN为原料,制备
和CH3CN为原料,制备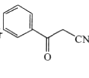 的合成路线(无机试剂任选)。_______________
的合成路线(无机试剂任选)。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,密闭容器中的H2在催化剂的催化下可高效转化酸性溶液中的硝态氮(![]() )以达到消除污染的目的。其工作原理的示意图如图:
)以达到消除污染的目的。其工作原理的示意图如图:
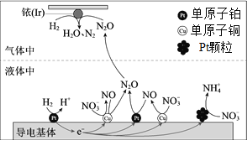
下列说法正确的是
A.导电基体上的正极产物仅有NO和![]()
B.若导电基体上的Pt颗粒增多,不利于降低溶液中的含氮量
C.若导电基体上只有单原子铜,![]() 能全部转化为N2O
能全部转化为N2O
D.若Ir的表面处理1molN2O,理论上负极消耗89.6LH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:(1)H2(g)+![]() O2(g)=H2O(g) ΔH1=akJ·mol-1
O2(g)=H2O(g) ΔH1=akJ·mol-1
(2)2H2(g)+O2(g)=2H2O(g) ΔH2=bkJ·mol-1
(3)H2(g)+![]() O2(g)=H2O(l) ΔH3=ckJ·mol-1
O2(g)=H2O(l) ΔH3=ckJ·mol-1
(4)2H2(g)+O2(g)=2H2O(l) ΔH4=dkJ·mol-1;下列关系式中正确的是( )
A.a<c<0B.2a=b<0C.b>d>0D.2c=d>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.化合物Ⅹ由四种短周期元素组成,加热X,可产生使湿润的红色石蕊试纸变蓝的气体Y,Y为纯净物;取![]() ,用含
,用含![]() 的盐酸完全溶解得溶液A,将溶液A分成
的盐酸完全溶解得溶液A,将溶液A分成![]() 和
和![]() 两等份,完成如下实验(白色沉淀C可溶于
两等份,完成如下实验(白色沉淀C可溶于![]() 溶液):
溶液):
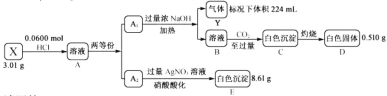
请回答:
(1)组成X的四种元素是N、H和_______(填元素符号),X的化学式是_________。
(2)溶液B通入过量![]() 得到白色沉淀C的离子方程式是______________。
得到白色沉淀C的离子方程式是______________。
(3)写出一个化合反应(用化学方程式或离子方程式表示)_____________。要求同时满足:
①其中一种反应物的组成元素必须是X中除N、H外的两种元素;
②反应原理与“![]() ”相同。
”相同。
Ⅱ.某兴趣小组为验证浓硫酸的性质进行实验,如图。实验中观察到的现象有:锥形瓶内有白雾,烧杯中出现白色沉淀。请回答:
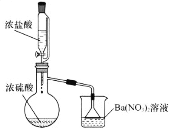
(1)将浓硫酸和浓盐酸混合可产生![]() 气体的原因是________。
气体的原因是________。
(2)烧杯中出现白色沉淀的原因是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com