
【题目】按要求完成下列各题。
(1)向澄清石灰水中通入过量CO2(写出离子方程式)___________________________________
(2)用稀硫酸洗铁锈(Fe2O3)(写出离子方程式)____________________________________
(3)2Al + 6H+ = 2Al3+ + 3H2↑(写出对应的化学方程式并用双线桥法标出电子转移情况)__________________
(4)在一定条件下,某化合物W受热分解:2W ![]() A↑+2B↑+4C↑,测得反应后生成的混合气体的密度是相同条件下H2密度的12倍,则W的摩尔质量是 _______
A↑+2B↑+4C↑,测得反应后生成的混合气体的密度是相同条件下H2密度的12倍,则W的摩尔质量是 _______
【答案】 CO2+OH-=HCO3- Fe2O3 +6H + =2Fe3+ + 3H2O 略 84g/mol
【解析】(1)向澄清石灰水中通入过量CO2反应生成碳酸氢钙和水,该离子反应为: CO2+OH-=HCO3-因此,本题正确答案为: CO2+OH-=HCO3-
(2)用稀硫酸洗铁锈( Fe2O3 )反应生成硫酸铁和水,该离子反应为:Fe2O3 +6H + =2Fe3+ + 3H2O
因此,本题正确答案为:Fe2O3 +6H + =2Fe3+ + 3H2O
(3)Al与盐酸的离子反应为2Al + 6H+ = 2Al3+ + 3H2↑,该反应为![]() ,该反应中Al元素由0价升高为+3价,H元素由+1价降低为0价,双线桥法标出电子转移为
,该反应中Al元素由0价升高为+3价,H元素由+1价降低为0价,双线桥法标出电子转移为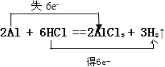 ,因此,本题正确答案为:
,因此,本题正确答案为: .
.
(3)令W的物质的量为![]() ,由方程式2W
,由方程式2W ![]() A↑+2B↑+4C↑,可以知道混合气体总物质的量为
A↑+2B↑+4C↑,可以知道混合气体总物质的量为![]() ,混合气体对氢气的相对密度为12,则混合气体平均摩尔质量=12
,混合气体对氢气的相对密度为12,则混合气体平均摩尔质量=12![]() 2g/mol=24g/mol,混合气体总质量=7mol
2g/mol=24g/mol,混合气体总质量=7mol![]() 24g/mol=168g,由质量守恒定律可以知道W的质量等于混合气体总质量,故W的摩尔质量=
24g/mol=168g,由质量守恒定律可以知道W的质量等于混合气体总质量,故W的摩尔质量=![]() =84g/mol。因此,本题正确答案为:84g/mol
=84g/mol。因此,本题正确答案为:84g/mol


科目:高中化学 来源: 题型:
【题目】高温下,某反应达平衡,平衡常数 ![]() .恒容时,温度升高,H2浓度减小.下列说法正确的是( )
.恒容时,温度升高,H2浓度减小.下列说法正确的是( )
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应的化学方程式为CO+H2OCO2+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将反应5IO3﹣+I﹣+6H+3I2+3H2O设计成如图所示的原电池.开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流计指针再次发生偏转.下列判断不正确的是( ) 
A.开始加入少量浓硫酸时,乙中石墨电极上发生氧化反应
B.开始加入少量浓硫酸时,同时在甲、乙烧杯中都加入淀粉溶液,只有乙烧杯中溶液变蓝
C.电流计读数为零时,反应达到化学平衡状态
D.两次电流计指针偏转方向相反
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫在空气中燃烧可以生成SO2 , SO2在催化剂作用下可以被氧化为SO3 , 其热化学方程式可表示为:S(g)+O2(g)═SO2(g)△H=﹣297kJ/mol,SO2(g)+ ![]() O2(g)SO3(g);△H=﹣98.3kJ/mol.如图是上述两个反应过程与能量变化的关系图,其中Ⅰ表示0.4mol SO2(g)、1.6mol SO3(g)、0.2mol O2(g)具有的能量,Ⅲ表示64gS(g)与96g O2(g)所具有的能量.
O2(g)SO3(g);△H=﹣98.3kJ/mol.如图是上述两个反应过程与能量变化的关系图,其中Ⅰ表示0.4mol SO2(g)、1.6mol SO3(g)、0.2mol O2(g)具有的能量,Ⅲ表示64gS(g)与96g O2(g)所具有的能量.
(1)Ⅰ→Ⅱ的反应是(填“吸热”,“放热”)反应.
(2)c为KJ.
(3)图示中b的大小对Ⅲ→Ⅱ反应的△H的影响是 .
A.△H随着b的增大而增大
B.△H随着b的增大而减小
C.△H随着b的减小而增大
D.△H不随b的变化而变化
(4)图中的d+e﹣b=KJ. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 因发生加成反应,苯可以使溴水褪色
B. 煤可以通过干馏、液化与气化等物理变化转化为清洁能源
C. 天然植物油常温下一般呈液态,难溶于水,有恒定的熔点、沸点
D. 分子式为C8H10且属于芳香烃的同分异构体有4种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com