
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
分析 (1)根据反应的化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比;
(2)某温度下,平衡浓度符合下式:c2(SO3)=c(O2)•c2(SO2),先计算化学平衡常数,根据表中数据确定温度;
(3)设该条件下O2的平衡转化率为x,
O2(g)+2SO2(g)?2SO3(g),
开始(mol)0.30 0.60 0
反应(mol)0.30x 0.60x 0.60x
平衡(mol)0.30(1-x) 0.60(1-x) 0.60x
SO3的物质的量分数(SO3的物质的量与反应体系中总的物质的量之比)为$\frac{4}{7}$,根据三氧化硫物质的量分数计算x值;该根据平衡常数概念计算K;
(4)设O2与SO2混合气体的物质的量分别为x、y,根据$\overline{M}$=$\frac{m总}{n总}$带入计算x、y可得.
解答 解:(1)反应O2(g)+2SO2(g)?2SO3(g),K=$\frac{{c}^{2}(S{O}_{3})}{c({O}_{2})•{c}^{2}(S{O}_{2})}$;
故答案为:$\frac{{c}^{2}(S{O}_{3})}{c({O}_{2})•{c}^{2}(S{O}_{2})}$;
(2)根据c2(SO3)=c(O2)•c2(SO2),代入K=$\frac{{c}^{2}(S{O}_{3})}{c({O}_{2})•{c}^{2}(S{O}_{2})}$=1,平衡常数只与温度有关,故此时温度为830℃;
故答案为:830;
(3)设该条件下O2的平衡转化率为x,
O2(g)+2SO2(g)?2SO3(g),
开始(mol)0.30 0.60 0
反应(mol)0.30x 0.60x 0.60x
平衡(mol)0.30(1-x) 0.60(1-x) 0.60x
SO3的物质的量分数为$\frac{4}{7}$,则$\frac{0.6x}{0.3(1-x)+0.6(1-x)+0.6x}$=$\frac{4}{7}$,解得x=$\frac{2}{3}$,设容器体积1L,K=$\frac{0.{4}^{2}}{0.{2}^{2}×0.1}$=40;
故答案为:$\frac{2}{3}$;40;
(4)设平均相对分子质量分别为57.6的混合气体O2与SO2混合气体的物质的量分别为x、y,则有$\frac{32x+64y}{x+y}$=56.7,解得$\frac{x}{y}$=$\frac{1}{4}$,混合气体5L,则O2有1LSO2有4L,则O2在混合气体中的体积分数为20%;同理设平均相对分子质量分别为44.8的混合气体O2与SO2混合气体的物质的量分别为a、b,有$\frac{32a+64b}{a+b}$=44.8,$\frac{a}{b}$=$\frac{3}{2}$,混合气体5L,则O2有3LSO2有2L,则O2在混合气体中的体积分数为60%;
故答案为:20%;60%.
点评 本题考查了化学平衡的有关计算,计算量大,学生要熟练掌握三段式解题的方法,并读清题目信息灵活运用,题目难度较大.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
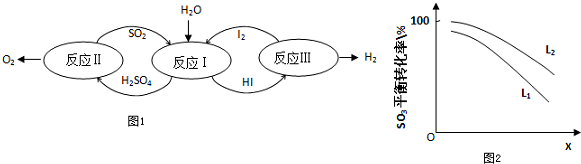
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
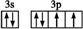 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
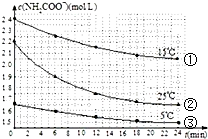 已知氨基甲酸铵发生的水解反应为:NH2COONH4+2H2O?NH4HCO3+NH3•H2O,某研究小组得到c(NH2COO-)随时间变化曲线如图所示.下列有关说法一定正确的是( )
已知氨基甲酸铵发生的水解反应为:NH2COONH4+2H2O?NH4HCO3+NH3•H2O,某研究小组得到c(NH2COO-)随时间变化曲线如图所示.下列有关说法一定正确的是( )| A. | 对比①与③,可知浓度越大水解速率越快 | |
| B. | 对比①与②,可知温度越高水解速率越快 | |
| C. | 加水稀释,平衡向正反应方向移动,K值增大 | |
| D. | 氨基甲酸铵在碱性条件下比在酸性条件下水解程度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,W与R形成的化合物的化学式为Na3N.它们的晶体属于离子晶体.
,W与R形成的化合物的化学式为Na3N.它们的晶体属于离子晶体.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com