
分析 常见的10电子分子有H2O、NH3、CH4、HF等,常见的10电子阳离子有Na+、Mg2+、Al3+、NH4+、H3O+,常见的10电子阴离子有F-、OH-,根据“B溶于A后所得的物质可电离出C和D”,可推出A为H2O、B为NH3、C为NH4+、D为OH-,再根据A、B、E反应后可得C和一种白色沉淀,可推出E为Mg2+或Al3+,以此解答.
解答 解:常见的10电子分子有H2O、NH3、CH4、HF等,常见的10电子阳离子有Na+、Mg2+、Al3+、NH4+、H3O+,常见的10电子阴离子有F-、OH-,根据“B溶于A后所得的物质可电离出C和D”,可推出A为H2O、B为NH3、C为NH4+、D为OH-,再根据A、B、E反应后可得C和一种白色沉淀,可推出E为Mg2+或Al3+,
(1)由上述分析可知,C为NH4+,D为OH-,
故答案为:NH4+;OH-;
(2)A为H2O、B为NH3,E为Mg2+或Al3+,A、B、E三种微粒反应的离子方程式为:Al3++3NH3+3H2O═Al(OH)3↓+3NH4+或Mg2++2NH3+2H2O═Mg(OH)2↓+2NH4+;
故答案为:Al3++3NH3+3H2O=Al(OH)3↓+3 NH4+或Mg2++2NH3+2H2O=Mg(OH)2↓+2NH4+.
点评 本题考查无机物的推断、离子反应等,题目难度中等,掌握常见的10电子微粒及其性质是推断的关键,B溶于A后所得的物质可电离出C和D为解答的突破口.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
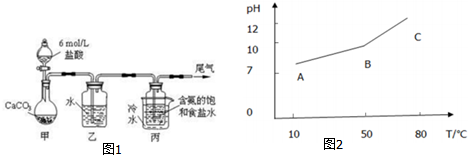
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂分子中都含有碳碳双键 | B. | 葡萄糖分子中含有羟基和醛基 | ||
| C. | 水分子中含有羟基 | D. | 乙酸乙酯分子中含有羧基 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
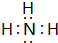 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 已知:A、B、C、D、E、F六种元素核电荷数依次增大,属于周期表中前四周期的元素.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满.请根据以上信息,回答下列问题:
已知:A、B、C、D、E、F六种元素核电荷数依次增大,属于周期表中前四周期的元素.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满.请根据以上信息,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加聚反应也可能有水生成 | |
| B. | 水、乙醇、氢氧化钠中都存在羟基 | |
| C. | 水可以参与有些有机反应,有些有机反应也有水生成 | |
| D. | 有水参加的有机化学反应都可以叫做水解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com