
【题目】可逆反应A(g)+B![]() C(g)+D达到平衡时,下列说法不正确的是( )
C(g)+D达到平衡时,下列说法不正确的是( )
A.若增大A的浓度,平衡体系颜色加深,D不一定是具有颜色的气体
B. 升高温度,C的百分含量减小,说明正反应是放热反应
C.增大压强,平衡不移动,说明B、D必是气体
D.若B是气体,增大A的浓度会使B的转化率增大
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案科目:高中化学 来源: 题型:
【题目】下列有关燃料的说法错误的是( )
A.燃料燃烧产物CO2是温室气体之一
B.化石燃料完全燃烧不会造成大气污染
C.以液化石油气代替燃油可减少大气污染
D.燃料不完全燃烧排放的CO是大气污染物之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L恒容密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
 (1)写出该反应的平衡常数表达式:K= 。
(1)写出该反应的平衡常数表达式:K= 。
已知:![]() >
>![]() ,则该反应是 热反应。
,则该反应是 热反应。
(2)图中表示NO2浓度的变化的曲线是 。

用O2表示从0—2s内该反应的平均速率υ(O2)= 。
(3)能说明该反应已达到平衡状态的是 。
a.C(NO2)=2C(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4) 为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离除NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3俗名纯碱,下面是对纯碱采用不同分类法的分类,不正确的是( )
A.Na2CO3是碳酸盐
B.Na2CO3是正盐
C.Na2CO3是钠盐
D.Na2CO3是碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
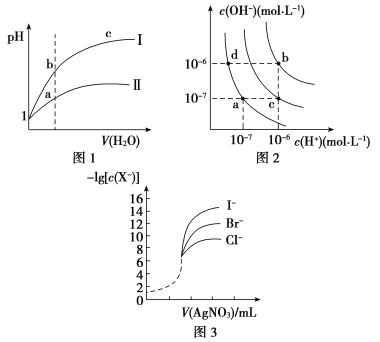
A.图1表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
B.图2中纯水仅升高温度,就可以从a点变到c点
C.图2中在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性
D.用0.010 0 mol/L硝酸银标准溶液,滴定浓度均为0.100 0 mol/L Cl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NH3催化还原NxOy可以消除氮氧化物的污染。
已知:反应I:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l) ΔH1
5N2(g)+6H2O(l) ΔH1
反应II:2NO(g)+O2(g)![]() 2NO2(g) ΔH2(且|ΔH1|=2|ΔH2|)
2NO2(g) ΔH2(且|ΔH1|=2|ΔH2|)
反应III:4NH3(g)+6NO2(g)![]() 5N2(g)+3O2(g)+6H2O(l) ΔH3
5N2(g)+3O2(g)+6H2O(l) ΔH3
反应I和反应II在不同温度时的平衡常数及其大小关系如下表
温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
298 | K1 | K2 | |
398 | K1′ | K2′ |
(1)ΔH3=_________(用ΔH1、ΔH2的代数式表示);推测反应III是________反应(填“吸热”或“放热”)。
(2)相同条件下,反应I在2 L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。
①计算0~4分钟在A催化剂作用下,反应速率v(NO)=______________。
②下列说法不正确的是__________。
A.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
D.增大压强能使反应速率加快,是因为增加了活化分子百分数
(3)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如右。溶液中OH向电极___________移动(填a或b),负极的电极反应式为________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中,不能运用化学平衡移动原理解释的是( )
A.实验室中用饱和食盐水除去氯气中的氯化氢气体
B.实验室中久置的浓氨水碱性减弱
C.向硝酸亚铁溶液中滴加盐酸,溶液变为黄色
D.在较高温度下测定二氧化氮气体相对分子质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com