
⑴中学化学教材中图示了NaCl晶体结构,它向三维空间延伸得到完美晶体。NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的核间距离为a×10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7g/mol)。![]()
![]()
![]()
![]()
![]()

![]()
![]()

⑵天然和绝大部分人工制备的晶体都存在各种缺陷,例如在某氧化镍晶体中就存在如图4-4所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。某氧化镍样品组成为Ni0.97O,试计算该晶体中Ni3+与Ni2+的离子数之比。
(1)62.3/a3 (2)6:91 ![]()
![]()
![]()
![]()
![]()

![]()
![]()
晶胞中阴、阳离子个数的确定通常采用“原子分割法”,具体如下:①处于顶点的离子,同时为8个晶胞共有,每个离子有1/8属于晶胞;②处于棱上的离子,同时为4个晶胞共有,每个离子有1/4属于晶胞;③处于面上的离子,同时为2个晶胞共有,每个离子有1/2属于晶胞;④处于内部的1个离子,则完全属于该晶胞,该离子数目为1。要确定NiO的密度,就应确定单位体积中NiO分子的个数,再结合NiO的摩尔质量求算出该晶体中NiO的质量,最后求出密度。本题解答如下:
 ⑴如图4-5所示,以立方体作为计算单元,此结构中含有
⑴如图4-5所示,以立方体作为计算单元,此结构中含有
Ni2+—O2-离子数为:4×![]() =
=![]() (个),所以1molNiO晶体中应含有
(个),所以1molNiO晶体中应含有
此结构的数目为6.02×1023÷![]() =12.04×1023(个),又因一个此结构的体积为(a×10-8cm)3,所以1molNiO的体积应为12.04×1023×(a×10-8cm)3,NiO的摩尔质量为74.7g/mol,所以NiO晶体的密度为
=12.04×1023(个),又因一个此结构的体积为(a×10-8cm)3,所以1molNiO的体积应为12.04×1023×(a×10-8cm)3,NiO的摩尔质量为74.7g/mol,所以NiO晶体的密度为
![]()
⑵解法一(列方程):设1molNi0.97O中含Ni3+为xmol,Ni2+为ymol,则得
![]() x+y=0.97 (Ni原子个数守恒)
x+y=0.97 (Ni原子个数守恒)
3x+2y=2 (电荷守恒)
解得x=0.06,y=0.91,故n(Ni3+):n(Ni2+)=6:91
解法二(十字交叉):由化学式Ni0.97O求出Ni的平均化合价为2/0.97,则有
![]()
![]() Ni3+ 3 0.06/0.97
Ni3+ 3 0.06/0.97
![]()
![]() 2/0.97
2/0.97
Ni2+ 2 0.91/0.97
故n(Ni3+):n(Ni2+)=6:91。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
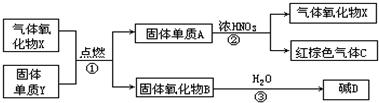 (2009?汕头模拟)X,Y,A,B,C,D是中学化学教材中常见的物质,且有图示的转化关系.气体C的式量比气体X的式量大2,D的焰色反应呈黄色,产物中水已忽略.
(2009?汕头模拟)X,Y,A,B,C,D是中学化学教材中常见的物质,且有图示的转化关系.气体C的式量比气体X的式量大2,D的焰色反应呈黄色,产物中水已忽略.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
(08潮阳一中模拟)(9分)X,Y,A,B,C,D是中学化学教材中常见的物质,且有图示的转化关系.气体C的式量比气体X的式量大2,D的焰色反应呈黄色,产物中水已忽略.
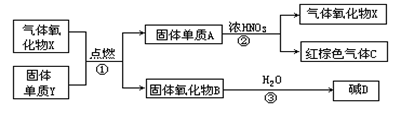
(1)写出有关物质的化学式:X Y D
(2)反应①的反应类型是(填基本反应类型) .
(3)反应② 的化学方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
将上述收满NH3的圆底烧瓶取下,改装成图乙所示的装置,胶头滴管内事先预吸入2 mL H2O,此时小气球系在玻璃管上呈自然松弛状态;将滴管内的水慢慢滴入烧瓶中,轻轻晃动烧瓶,通过观察实验现象便可以验证NH3的某个性质。按要求回答下列问题:

(1)中学化学教材中是通过固体物质间加热反应来制取NH3的,该化学方程式为:
________________________________________________________________。
(2)下面是某同学关于王老师能用图甲制取NH3的原因分析,有道理的是_________________。
①在NH3·H2O中有平衡NH3+H2O![]() NH3·H2O
NH3·H2O![]()
![]() +OH-,NaOH使平衡向左移动
+OH-,NaOH使平衡向左移动
②在NH3·H2O中有平衡NH3+H2O![]() NH3·H2O
NH3·H2O![]()
![]() +OH-,NH4Cl使平衡向左移动
+OH-,NH4Cl使平衡向左移动
③NaOH溶于水时放热,使体系的温度升高,NH3的溶解度减小
④NH4Cl与NaOH在此情况下可反应生成NH3,即![]() +OH-
+OH-![]() NH3↑+H2O
NH3↑+H2O
⑤NH4Cl会分解释放出NH3
(3)图甲中的NH4Cl与NaOH固体混合物能否用CaO固体代替__________(填“能”与“不能”)
(4)如何判断图甲中烧瓶已收满NH3? _______________________________________________。
(5)图乙中胶头滴管中的水挤入烧瓶后,观察到的现象是_______________________________,它说明了NH3________________________________________________________。
Ⅱ.如图所示:在B槽中装有500 mL水,容积为a mL的试管A充满了NO2和NO的混合气体(标准状况),将试管A倒插入B槽的水中。充分反应后,试管A中余下气体的体积为0.

通过导气管C往余下0.5a mL气体的试管A中通入氧气,当试管A中充满液体时停止通入氧气,则共通入氧气的体积为__________mL,然后将试管取出水槽,水槽B中溶液的物质的量浓度为_________mol·L-1(设溶液的体积仍为500 mL)。
查看答案和解析>>
科目:高中化学 来源:同步题 题型:计算题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com