
 如图是一组探究氯气性质的装置.
如图是一组探究氯气性质的装置.分析 氯气不具有漂白性,具有漂白性的是次氯酸,氯气与水反应生成次氯酸,要使有色布条褪色,则通入Ⅱ中的氯气必须含有水分,据此分析解答.
解答 解:(1)现关闭活塞K,若有色布条是干燥的,溶液A为浓硫酸,则氯气通过浓硫酸被干燥,干燥的氯气不具有漂白性,所以有色布条不褪色;若溶液A为水,则进入Ⅱ中的氯气含有水蒸气,氯气与水反应生成次氯酸,次氯酸具有漂白性,能够使有色布条褪色;若溶液A为饱和的Na2CO3溶液,氯气和水反应生成盐酸和次氯酸,盐酸和碳酸钠反应而被吸收,通入到Ⅱ中的气体不含氯气,不能反应生成次氯酸,有色布条不褪色;
故答案为;不褪色;褪色;不褪色;
(2)现打开K,溶液A为氢氧化钠溶液,氯气不通过氢氧化钠反应,湿润的氯气能够生成次氯酸,所以有色布条褪色;
故答案为:褪色.
点评 本题考查了元素化合物性质,熟悉氯气、次氯酸的性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 德国化学家维勒首次实现了人工合成有机物 | |
| B. | 原子吸收光谱常用来确定物质中含有非金属元素 | |
| C. | 所有金属元素都可以用焰色反应来确定其存在 | |
| D. | SO2能溶于水,水溶液能导电,所以SO2是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 置换反应 | C. | 分解反应 | D. | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | M与A均能使酸性高锰酸钾溶液和溴水褪色 | |
| B. | B能发生消去、氧化、取代、缩聚等反应 | |
| C. | 1molM与足量烧碱溶液反应,可消耗2nmolNaOH | |
| D. | A、B、C各1mol分别与金属钠反应,放出气体的物质的量之比为1:2:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了提取电子垃圾中有用的金属,可将其进行焚烧 | |
| B. | 模型一般可分为物体模型和思维模型 | |
| C. | 某同学研究SO2性质的程序是分类(预测SO2的化学性质)→观察(得出SO2的物理性质)→实验→比较并得出结论 | |
| D. | 科学实验能解决化学学科的所有问题 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L1mol•L-1的Na2CO3溶液中含有CO32-的数目为NA | |
| B. | 28g的乙烯和丙烯中含碳原子数目为NA | |
| C. | 标准状况下,6.72LNO2与水充分反应转移的电子数目为0.1NA | |
| D. | 常温常压下,14g由N2与CO组成混合气体含有的原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在实验室中某实验小组同学关于硫酸铜的制取和应用,设计了以下实验:
在实验室中某实验小组同学关于硫酸铜的制取和应用,设计了以下实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
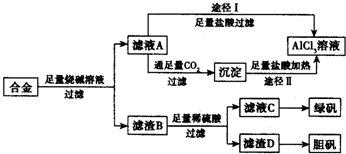 工业上用含有铝、铁、铜的合金工业废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4•7H2O) 和胆矾晶体(CuSO4•5H2O)设计了如下方案如图所示:请回答相关问题:
工业上用含有铝、铁、铜的合金工业废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4•7H2O) 和胆矾晶体(CuSO4•5H2O)设计了如下方案如图所示:请回答相关问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某温度时,在VL密闭容器中,A、B、C三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
某温度时,在VL密闭容器中,A、B、C三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com