
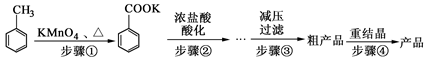
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 在水中溶解性 |
| 甲苯 | -95 | 110.6 | 0.8669 | 难溶 |
| 苯甲酸钾 | 121.5~123.5 |  |  | 易溶 |
| 苯甲酸 | 122.4 | 248 | 1.2659 | 微溶 |
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源:不详 题型:填空题

| 序号 | 温度范围/℃ | 热分解方程式 | 固体失重率 |
| ① | 120~220 | | 19.67% |
| ② | 280~310 | | 56.10% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 向某溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| C | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊 | 该溶液中一定有CO32- |
| D | 用洁净的铂丝蘸取某溶液,在无色火焰上灼烧,观察到火焰颜色为黄色 | 该溶液中一定含有Na+,可能含有K+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | X | Y | Z |
| A | NaHCO3溶液 | Na2CO3 | BaCl2溶液 |
| B | FeCl3溶液 | CuCl2 | Fe |
| C | Fe2O3 | Al2O3 | NaOH溶液 |
| D | Na2SO4溶液 | Na2CO3 | 盐酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
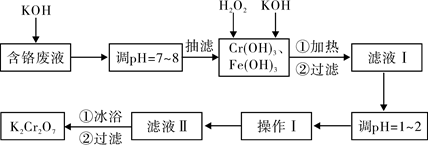
| 物质 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
| KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 | 56.3 |
| K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 | 24.1 |
| K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 | 102.0 |
| KNO3 | 13.9 | 31.6 | 61.3 | 106 | 167 | 246.0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

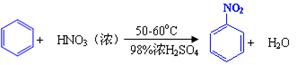
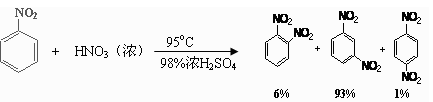
| 物质 | 熔点/℃ | 沸点/℃ | 密度(20 ℃) / g·cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 1,3-二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 |  | 83 | 1.4 | 易溶于水 |
| 浓硫酸 |  | 338 | 1.84 | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 操作 | 现象 | 结论 |
| A. | 向某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| B. | 向某无色溶液中滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| C. | 用洁净铂丝蘸取某溶液进行焰色反应 | 火焰呈黄色 | 溶液中有K+ |
| D. | 将某气体通入品红溶液中 | 品红溶液褪色 | 该气体一定是SO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用过量氨水除去Al3+溶液中的少量Fe3+ |
| B.将混合气体通过灼热的铜网除去N2中的少量O2 |
| C.向某溶液中加HCl酸化的BaCl2溶液,产生白色沉淀,则该溶液中一定含有SO42- |
| D.向澄清石灰水中通入少量气体产生沉淀,过量时沉淀溶解,说明该气体一定是CO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com