
【题目】侯氏制碱法原理是:NH3+H2O+CO2+NaCl=NaHCO3↓+NH4Cl析出碳酸氢钠,下列实验装置及原理设计说法不合理的是:
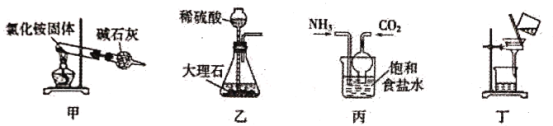
A.用装置甲制取氨气时得到氨气很少,主要原因是分解得到NH3、HCl的遇冷会重新化合
B.用装置乙生成的CO2速率很慢,原因是反应生成微溶于水的硫酸钙,覆盖着大理石的表面
C.用装置丙模拟侯氏制碱法,可以同时通入NH3、CO2,也可以先通氨气再通CO2
D.用装置丁分离得到产品NaHCO3,为得到干燥产品,也可采用减压过滤
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A.碳酸钠的水解反应CO32-+H2O=HCO3-+OH -
B.碳酸氢钙与过量的NaOH溶液反应Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
C.苯酚钠溶液与二氧化碳反应C6H5O-+CO2+H2O=C6H5OH+CO32-
D.稀硝酸与过量的铁屑反应3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴乙烷(C2H5Br)的装置和步骤如下:(已知溴乙烷的沸点38.4℃)①检查装置的气密性,向装置图所示的∪形管和大烧杯中加入冰水;②在圆底烧瓶中加入10mL95%乙醇、28mL78%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;③小心加热,使其充分反应.回答下列问题:

(1)该实验制取溴乙烷的化学方程式为:__.
(2)反应时若温度过高,可看到有红棕色气体产生,该气体分子式为__,同时生成的无色气体分子式为__.
(3)为了更好的控制反应温度,除用图示的小火加热,更好的加热方式是__.
(4)U型管内可观察到的现象是__.
(5)反应结束后,∪形管中粗制的C2H5Br呈棕黄色.为了除去粗产品中的杂质,可选择下列试剂中的__(填序号).
(a)NaOH溶液 (b)H2O (c)Na2SO3溶液 (d)CCl4
所需的主要玻璃仪器是__(填仪器名称).要进一步制得纯净的C2H5Br,可用水洗,然后加入无水CaCl2,再进行__(填操作名称).
(6)下列几项实验步骤,可用于检验溴乙烷中溴元素,其正确的操作顺序是:取少量溴乙烷,然后__(填代号).
①加热;②加入AgNO3溶液;③加入稀HNO3酸化;④加入NaOH溶液;⑤冷却.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.124 g P4(分子结构: ![]() )中的共价键数目为6NA
)中的共价键数目为6NA
B.11g超重水(T2O)含有的电子数比中子数多NA
C.标准状况下,22.4 L CHCl3中的C-Cl键的数目等于0.3NA
D.标准状况下,11.2 L Cl2溶于水呈黄绿色,溶液中Cl-、ClO-和HClO的微粒数之和为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B ![]() 3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A.v(A)=2 mol·L-1·s-1B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1D.v(D)=1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三苯甲醇是有机合成中间体。实验室用格式试剂(![]() )与二苯酮反应制备三苯甲醇。
)与二苯酮反应制备三苯甲醇。
已知:①格式试剂非常活泼,易与水反应
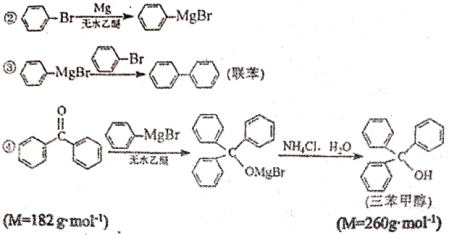
实验过程如下:
①合成格氏试剂:实验装置如图1所示,向三颈烧瓶加入0.75g镁屑和1小粒碘,装好装置,在恒压漏斗中加入3.20 mL溴苯(0.03 mol)和15.00 mL乙醚混匀,开始缓慢滴入三颈烧瓶,滴完后待用。
②制备三苯甲醇:实验装置如图1所示,将5.5g二苯酮与15 mL乙醇在恒压漏斗中混匀,滴入三颈烧瓶。40℃左右水浴回流0.5h,加入20mL饱和氯化铵溶液,使晶体析出,经过系列操作得到粗产品。
③提纯:用图2所示装置进行提纯,最后冷却抽滤.
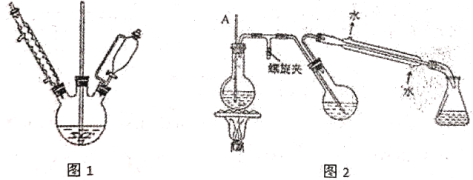
(1)实验中乙醚溶剂必须预先用_______试剂除去溶解在其中痕量的水,再经过_______得到;
A 浓硫酸 B 金属钠 C 过滤 D 蒸馏
(2)图1实验中,实验装置存在缺陷,应在球形冷凝管上连接_________装置;
(3)合成格氏试剂过程中,如果混合液滴加过快将导致格氏试剂产率下降,其原因是_______;
(4)在制备三苯甲醇的过程中,不能先将20mL饱和氯化铵溶液一起加入后再水浴回流的原因是__________;
(5)步骤②中系列操作为_________、过滤、洗涤、_________;
A 蒸发结晶 B 冷却结晶 C 高温烘干 D 滤纸吸干
(6)下列关于减压过滤的操作或说法正确的是________
A 滤纸大小适当,盖满所有孔,用溶剂润湿滤纸,微开水龙头,抽气使滤纸紧贴漏斗瓷板上
B 不宜过滤胶状沉淀,因为胶状沉淀颗粒太小易在滤纸上形成一层密实的沉淀
C 减压过滤完毕,先关闭水龙头,后拆下连接抽气泵和吸滤瓶的橡皮管,防止倒吸
D 实验过程要注意吸滤瓶内液面高度,当快到达支管口位置时,应先拔掉吸滤瓶上的橡皮管,再从支管口倒出滤液
E 当过滤的溶液具有强酸性、强氧化性时,可用玻璃纤维代替滤纸或用玻璃砂漏斗代替布氏漏斗
(7)通过提纯得到产品4.00g,则本实验产率为_________(计算结果保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.将0. 5mol N2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3 H2(g) ![]() 2 NH3(g) ΔH=-38.6kJmol-1
2 NH3(g) ΔH=-38.6kJmol-1
B.C(石墨)=C(金刚石)ΔH=+1.9kJmol-1,说明金刚石比石墨稳定
C.甲烷的燃烧热△H=-890. 3 kJmol-1,甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890. 3 kJmol-1
D.已知H+(aq)+OH-(aq)=H2O(l)△H=-57.4 kJmol-1,20g氢氧化钠固体溶于稀盐酸中恰好完全反应时放出的热量大于28.7kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.完成下列各题:

(1)正四面体烷的分子式为________________,其二氯取代产物有_________种;
(2)关于乙烯基乙炔分子的说法错误的是:________。
a、能使酸性KMnO4溶液褪色
b、1摩尔乙烯基乙炔能与3摩尔Br2发生加成反应
c、生成乙烯基乙炔分子的反应属于取代反应
d、等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(3)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式:________________;
(4)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举两例): ________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中一定正确的是
A.0.1mol/L的CH3COOH溶液中,由水电离出的c(H+)为10﹣13 mol/L
B.pH=2与pH=1的CH3COOH溶液中c(H+)之比为1:10
C.仅含有Na+、H+、OH﹣、CH3COO﹣四种离子的某溶液中可能存在:c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)
D.1.0 molL﹣1Na2CO3溶液:c(OH﹣)=c(HCO3﹣)+c(H+)+2c(H2CO3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com