
| A. | KClO3=K++Cl-+3O2- | B. | K2CO3=2K++CO32- | ||
| C. | NaOH=Na++OH- | D. | NH4Cl=NH4++Cl- |
分析 A.氯酸钾是强电解质,完全电离生成钾离子与氯酸根离子,氯酸根离子不能拆写;
B.碳酸钾属于盐,为强电解质,完全电离出钾离子和碳酸根离子;
C.氢氧化钠属于强碱,完全电离出钠离子和氢氧根离子;
D.氯化铵为强电解质,完全电离出铵离子和氯离子.
解答 解:A.氯酸钾是强电解质,完全电离生成钾离子与氯酸根离子,电离方程式:KClO3═K++ClO3-,故A错误;
B.碳酸钾属于盐,为强电解质,完全电离,电离方程式:K2CO3=2K++CO32-,故B正确;
C.NaOH是强电解质,在水溶液完全电离,电离方程式为NaOH═Na++OH-,故C正确;
D.氯化铵为强电解质,溶于水电离出铵离子和氯离子,电离方程式为:NH4Cl═NH4++Cl-,故D正确;
故选A.
点评 本题考查了电离方程式的判断,明确电解质的强弱及电离方程式的书写方法,并会判断方程式的正误是解答关键,题目难度不大.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
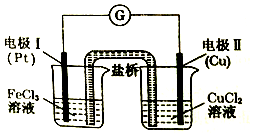
| A. | 盐桥中装有含氯化钾的琼脂,K+移向左池,Cl-移向右池 | |
| B. | 电极I上发生还原反应,电极反应式:Fe3++3e-=Fe | |
| C. | 电极Ⅱ作负极,铜电极逐渐溶解 | |
| D. | 该原电池的总反应为2 Fe3++Cu=Cu2++2Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向含有少量KSCN的FeI2溶液中滴加少量溴水,溶液出现血红色 | |
| B. | 用NH4HCO3固体以及其他固体药品能制得纯净的NH3 | |
| C. | 将SO2通入酸性KMnO4溶液中,溶液褪色,体现了SO2的漂白性 | |
| D. | 加热条件下,过量的Fe与浓硫酸反应只生成SO2一种气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol纯物质完全燃烧时所放出的热量,叫该物质的燃烧热 | |
| B. | 放热反应热化学方程式中△H就是该反应物的燃烧热 | |
| C. | 物质的燃烧热可利用仪器由实验测得 | |
| D. | 物质燃烧必然伴随发光发热现象且肯定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 臭氧的摩尔质量是48g | |
| B. | 同温同压条件下,等质量的氧气和臭氧体积比为2:3 | |
| C. | 16g臭氧中含有6.02×1023个原子 | |
| D. | l.00mol臭氧中含有电子总数为18×6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 第I栏 | 第II栏 | 第Ⅲ栏 |
| A | 往少量NaOH溶液中投入铝片 | 往过量NaOH溶液中 投入铝片 | 2Al+2OH-+2H2O═2AlO2-+3H2↑ |
| B | 往Fe2( SO4)3溶液 中滴入氢氧化钠溶液 | 往Fe2 (SO4)3溶液 中滴入氢氧化钡溶 液 | Fe3++3OH=Fe(OH)3↓ |
| C | NaHCO3溶液滴入Ca(OH)2 | NaHCO3溶液滴入NaOH溶液 | Ca2++OH-+HCO3-=CaCO3↓+H2O |
| D | 往NaOH泪液中通入过量CO2气体 | 往NaOH溶液中通入少量CO2气体 | CO2+OH-=HCO3- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com