
【题目】50ml浓H2SO4溶液(足量)中加入3.2g Cu,在加热条件下充分反应:
(1)反应消耗的H2SO4的物质的量是 , 生成SO2的体积为(标准状况下)mL.
(2)若题干中浓硫酸的物质的量浓度为a molL﹣1 , 投入足量的铜片加热,充分反应后,被还原的硫酸的物质的量n(H2SO4)0.025a mol(填“等于”、“大于”或“小于”).
(3)将题干中反应后的溶液稀释到500mL,取出50mL,并向取出液中加入足量的BaCl2溶液,得到沉淀19.81g,求原浓硫酸的物质的量浓度.
【答案】
(1)0.1mol;1120
(2)小于
(3)解:反应后的溶液加入足量的BaCl2溶液,得到沉淀19.81g为BaSO4,其物质的量= ![]() =0.085mol,可知500mL溶液中n(SO42﹣)=0.085mol×
=0.085mol,可知500mL溶液中n(SO42﹣)=0.085mol× ![]() =0.85MOL,根据S元素守恒可知n(H2SO4)=n(SO42﹣)+n(SO2)=0.85mol+0.05mol=0.9mol,故原浓硫酸的物质的量浓度=
=0.85MOL,根据S元素守恒可知n(H2SO4)=n(SO42﹣)+n(SO2)=0.85mol+0.05mol=0.9mol,故原浓硫酸的物质的量浓度= ![]() =18mol/L,
=18mol/L,
答:原浓硫酸的物质的量浓度为18mol/L
【解析】解:(1)3.2gCu的物质的量= ![]() =0.05mol,由方程式Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O可知,反应消耗的H2SO4的物质的量=2n(Cu)=2×0.05mol=0.1mol,生成SO2的物质的量=n(Cu)=0.05mol,故生成SO2的 体积=0.05mol×22.4L/mol=1.12L=1120mL,
=0.05mol,由方程式Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O可知,反应消耗的H2SO4的物质的量=2n(Cu)=2×0.05mol=0.1mol,生成SO2的物质的量=n(Cu)=0.05mol,故生成SO2的 体积=0.05mol×22.4L/mol=1.12L=1120mL,
故答案为:0.1mol;1120;(2)50mL a molL﹣1浓硫酸中硫酸的物质的量=0.05L×a molL﹣1=0.05a mol,投入足量的铜片加热,反应中浓硫酸其氧化剂与酸性作用且各占一半,随反应进行浓硫酸变稀,Cu与稀硫酸不反应,故充分反应后,被还原的硫酸的物质的量n(H2SO4)<0.05a mol× ![]() =0.025a mol,
=0.025a mol,
故答案为:小于;
(1)根据n= ![]() 计算3.2gCu的物质的量,再根据方程式Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O计算;(2)反应中浓硫酸其氧化剂与酸性作用且各占一半,随反应进行浓硫酸变稀,Cu与稀硫酸不反应,据此解答;(3)反应后的溶液加入足量的BaCl2溶液,得到沉淀19.81g为BaSO4 , 根据n=
计算3.2gCu的物质的量,再根据方程式Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O计算;(2)反应中浓硫酸其氧化剂与酸性作用且各占一半,随反应进行浓硫酸变稀,Cu与稀硫酸不反应,据此解答;(3)反应后的溶液加入足量的BaCl2溶液,得到沉淀19.81g为BaSO4 , 根据n= ![]() 计算BaSO4的物质的量,进而计算500mL溶液中n(SO42﹣),根据S元素守恒可知n(H2SO4)=n(SO42﹣)+n(SO2),再根据c=
计算BaSO4的物质的量,进而计算500mL溶液中n(SO42﹣),根据S元素守恒可知n(H2SO4)=n(SO42﹣)+n(SO2),再根据c= ![]() 计算.
计算.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】若将12.8g铜与一定量的浓硝酸反应,铜耗完时,共产生气体(NO和NO2的混合物)5.6L(标准状况).则所消耗的硝酸的物质的量为 , 所得气体的平均相对分子量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为( )
A.9.02 g
B.8.51 g
C.8.26 g
D.7.04 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl36H2O晶体.(图中夹持及尾气处理装置均已略去)请回答下列问题: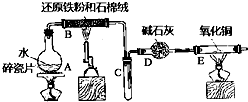
(1)装置B中发生反应的化学方程式是 .
(2)E中出现的现象是 .
(3)该小组把B中反应后的产物加入足量的盐酸,用该溶液制取FeCl36H2O晶体.
①欲检验溶液中含有Fe3+ , 选用的试剂为 , 现象是 .
②该实验小组同学用上述试剂没有检测到Fe3+ , 用离子方程式解释滤液中不存在Fe3+可能的原因: .
③将此滤液中FeCl2完全氧化为FeCl3最好选择下列物质中的 .
A.酸性KMnO4溶液 B.Cl2 C.Na2O2 D.FeCl3
④在③所得溶液浓缩结晶前需要用实验证明FeCl2已完全氧化,实验方法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】mg某双原子分子的气体在标准状况下的体积为V1L,其摩尔质量为Mg/mol,将其溶于水(该气体与水不反应)得到体积为V2L的溶液,NA表示阿伏加德罗常数的值,则下列错误的是( )
A.该气体分子的摩尔质量为![]() g/mol
g/mol
B.该气体分子中含有的原子数目为![]() g/mol
g/mol
C.该气体溶于水后得到溶液的物质的量浓度为![]() mol/L
mol/L
D.该气体溶于水后得到溶液的物质的量浓度![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10mL 0.05mo1/L的某金属硫酸盐溶液中,滴加0.1mo1/L BaCl2溶液,生成沉淀质量与加入BaCl2溶液体积关系如图所示,10mL该硫酸盐与足量的氢氧化钠完全反应生成10﹣3 mol沉淀,则该金属硫酸盐中金属元素的化合价为( ) 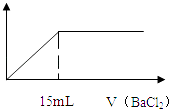
A.+1
B.+2
C.+3
D.+4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有如下三个热化学方程式: H2(g)+ ![]() O2(g)═H2O(g)△H=a kJmol﹣1
O2(g)═H2O(g)△H=a kJmol﹣1
H2(g)+ ![]() O2(g)═H2O(l)△H=b kJmol﹣1
O2(g)═H2O(l)△H=b kJmol﹣1
2H2(g)+O2(g)═2H2O(l)△H=c kJmol﹣1
关于它们的下列表述正确的是( )
A.它们都是吸热反应
B.a、b和c均为正值
C.a=b
D.2b=c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO(g)+ ![]() O2(g)=CO2(g);△H=﹣283kJ/mol
O2(g)=CO2(g);△H=﹣283kJ/mol
Na2O2(s)+CO2(g)═Na2CO3(s)+ ![]() O2(g);△H=﹣226kJ/mol
O2(g);△H=﹣226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
A.CO的燃烧热为283kJ
B.
如图可表示由CO生成CO2的反应过程和能量关系
C.Na2O2(s)+CO(g)=Na2CO3(s);△H=﹣509kJ/mol
D.Na2O2(s)与CO2(g)反应放出226kJ热量时,电子转移数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com