
| 74.5×2 |
| 74.5×2+111 |
| 1 |
| 2+1 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 海水是资源宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.
海水是资源宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、有8个中子的碳原子的核素符号:
| ||
B、H2O的电子式 | ||
C、Cl-的结构示意图: | ||
D、CH4分子的比例模型 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 可逆反应aA(g)+bB(g)?cC(g)+dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图.下列叙述正确的是( )
可逆反应aA(g)+bB(g)?cC(g)+dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图.下列叙述正确的是( )| A、达平衡后,加入催化剂则C%增大 |
| B、达平衡后,若升温,平衡左移 |
| C、化学方程式中b>c |
| D、达平衡后,减少A的量有利于平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子序数:W>X>Y>Z |
| B、原子半径:r(w)>r(X)>r(Y)>r(Z) |
| C、W的最高价氧化物的水化物碱性比X的弱 |
| D、Y的简单氢化物的稳定性比Z的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A 验证化学能转化为电能 | B 验证温度对化学平衡的影响 |
C 验证铁钉发生吸氧腐蚀 | D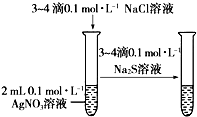 验证AgCl溶解度大于Ag2S |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com