
| A. | 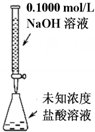 可以进行酸碱中和滴定实验 | |
| B. | 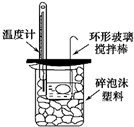 可以进行中和热的测定实验 | |
| C. | 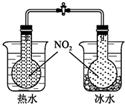 可验证温度对化学平衡的影响 | |
| D. | 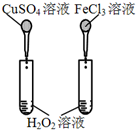 比较Cu2+、Fe3+对H2O2分解速率的影响 |
分析 A.碱式滴定管的下方是橡胶管;
B.温度计应该测量溶液的温度;
C.可以根据圆底烧瓶中气体的颜色变化判断温度的影响;
D.硫酸铜、氯化铁的阴离子、阳离子均不相同.
解答 解:A.碱式滴定管的下方是橡胶管,图中滴定管是酸式滴定管,只能盛放酸,故A错误;
B.中和热的测定中,温度计应该测量溶液的温度,故B错误;
C.根据烧瓶内气体的颜色深浅,判断可逆反应的方向,利用该装置可验证温度对化学平衡的影响,故C正确;
D.硫酸铜、氯化铁的阴离子、阳离子均不相同,不能比较Cu2+、Fe3+对H2O2分解速率的影响,也可能与阴离子有关,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及中和滴定、中和热测定、化学平衡以及化学反应速率的影响因素等知识,把握化学反应原理、实验技能为解答的关键,注意实验的评价性分析及控制变量法的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,3.36L SO3含有的原子数目为0.6NA | |
| B. | 1 molNa2O2与足量的水反应,转移的电子数为2NA | |
| C. | 在常温常压下,13.8克NO2与足量水充分反应,剩余气体的分子数为0.1NA | |
| D. | 在1 L lmol•L-1的氨水中,含有的NH3与NH3•H2O分子的总数等于1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28gCO与N2的混合物中含有的分子总数为NA | |
| B. | 常温、常压下,22.4LO2中含有的O2分子数为NA | |
| C. | 1L1mol•L-1K2SO4溶液中含有的钾离子数为2NA | |
| D. | 过量的铁1molCl2充分反应时,铁失去的电子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com