


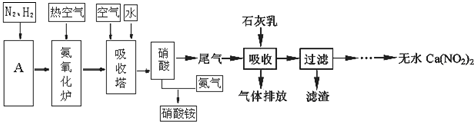
| A. | 反应①、③的原子利用率均为100% | |
| B. | 两种流程最终分离HCOOH都用洗涤液分液法 | |
| C. | 从原料充分利用角度看,流程二比流程一更优 | |
| D. | 两种流程总反应均为CO+H2O→HCOOH |
分析 A.反应物全部得到生成物;
B.甲酸钠和甲酸都易溶于水;
C.④水解生成的甲醇能循环利用;
D.流程一为2CO+2NaOH+H2SO4=Na2SO4+2HCOOH.
解答 解:A.反应物全部得到生成物,原子利用率均为100%,故A正确;
B.甲酸钠和甲酸都易溶于水,不能用洗涤液分液法,故B错误;
C.④水解生成的甲醇能循环利用,利用率更高,故C正确;
D.流程一为2CO+2NaOH+H2SO4=Na2SO4+2HCOOH,流程二为CO+H2O→HCOOH,故D错误.
故选AC.
点评 本题考查化学实验方案评价,为高频考点,涉及实验流程分析等,把握反应原理及反应与现象的关系为解答的关键,注意从实验的评价性及物质性质分析解答,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
 CH3+;
CH3+; CH3-.
CH3-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CO+3H2.
CO+3H2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 炼铁过程中的铁元素 | B. | 炼铁过程中的氧元素 | ||
| C. | 炼铁过程中的碳元素 | D. | 炼钢过程中的铁元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌作阳极,铁制品作阴极,溶液中含Zn2+ | |
| B. | 锌作阳极,铁制品作阴极,溶液中含Fe3+ | |
| C. | 锌作阴极,铁制品作阳极,溶液中含Zn2+ | |
| D. | 锌作阴极,铁制品作阳极,溶液中含Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $\stackrel{KMnO_{4}(H+)}{→}$
$\stackrel{KMnO_{4}(H+)}{→}$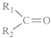 +
+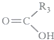
 .
.
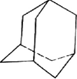 )是月桂烯的一种同分异构体,其一氯代物有2种.
)是月桂烯的一种同分异构体,其一氯代物有2种. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH4HCO3稀溶液与过量的KOH溶液反应:NH4++HCO3-+2OH-→CO32-+NH3•H2O+H2O | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-→2 Al(OH)3↓+3BaSO4↓ | |
| C. | 向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2→2 Fe3++2 Br2+6 Cl- | |
| D. | 醋酸除去水垢:2H++CaCO3→Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煎炸食物的花生油和牛油都是可皂化的饱和酯类 | |
| B. | 制饭勺、饭盒、高压锅等的不锈钢是合金 | |
| C. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com