
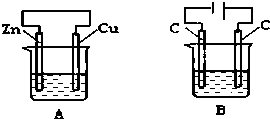
 仔细观察图A、B两个装置,两个烧杯分别盛有足量的CuSO4溶液,回答问题:
仔细观察图A、B两个装置,两个烧杯分别盛有足量的CuSO4溶液,回答问题:
| ||
| ||


科目:高中化学 来源: 题型:
| 物质 组别 | 甲 | 乙 | 丙 |
| A | Al | HCl | NaOH |
| B | NH3 | O2 | HNO3 |
| C | SiO2 | NaOH | HF |
| D | SO2 | Ca(OH)2 | NaHCO3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 向一容积不变的密闭容器中充入一定量A和B,发生如下反应:x A(g)+2B(s)?y C(g);△H<0
向一容积不变的密闭容器中充入一定量A和B,发生如下反应:x A(g)+2B(s)?y C(g);△H<0查看答案和解析>>
科目:高中化学 来源: 题型:
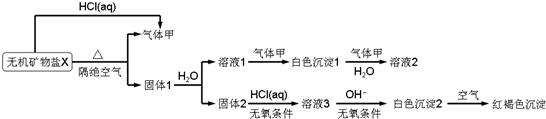
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯酚溶液中加入FeCl3溶液后酸性大大增强 |
| B、向Na2S2O3稀溶液中加入稀硫酸,发生如下反应:S2O32-+2H+═SO2↑+S↓+H2O,利用产生浑浊的快慢或产生气泡的快慢可以测定该反应在不同条件下的反应速率 |
| C、中和滴定中常用邻苯二甲酸氢钾作为基准物质来标定NaOH溶液,这是因为邻苯二甲酸氢钾纯度高,组成稳定,且相对分子质量较大 |
| D、实验室里吸入刺激性的氯气、氯化氢气体中毒时,可吸入少量酒精或乙醚的混合蒸气解毒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com