
| 氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Mg(OH)2 | 9.3 | 10.8 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
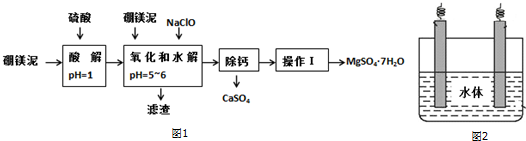
分析 硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,加入硫酸酸解PH=1,得到溶液硫酸镁、硫酸钙、硫酸锰、硫酸铁、硫酸亚铁、硫酸铝,加入次氯酸钠氧化亚铁离子为铁离子,沉淀锰离子,过滤后的滤液中利用溶解度随温度变化,除去硫酸钙,得到硫酸镁溶液,通过蒸发浓缩趁热过滤得到MgSO4•7H2O;
(1)影响反应速率的外界因素通常有温度和浓度,固体溶解时还可以通过搅拌、粉碎;
(2)次氯酸根离子具有强的氧化性,除能够氧化二价锰离子生成二氧化锰;因亚铁离子也具有还原性,能够被次氯酸钠氧化,生成的Fe3+很容易水解生成Fe(OH)3;
(3)硼镁泥主要成份是MgO,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,其中酸溶时只有SiO2不溶于水,生成的CaSO4是微溶于水的,经氧化调整溶液pH后,还有Fe(OH)3、Al(OH)3、MnO2不溶物生成,都可以通过过滤进入滤渣;
(4)根据表中温度对硫酸镁、硫酸钙的影响完成,温度越高,硫酸钙溶解度越小,滤液蒸发结晶后得到的晶体,可利用过滤得到;
(5)根据硼镁泥中MgO的质量分数(占40%),计算出生成MgSO4•7H2O质量及产率;
(6)金属的防腐措施有多种,利用电化原理防护的牺牲阳极的阴极保护法和外接电源的阴极保护法.
解答 解:硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,加入硫酸酸解PH=1,得到溶液硫酸镁、硫酸钙、硫酸锰、硫酸铁、硫酸亚铁、硫酸铝,加入次氯酸钠氧化亚铁离子为铁离子,沉淀锰离子,过滤后的滤液中利用溶解度随温度变化,除去硫酸钙,得到硫酸镁溶液,通过蒸发浓缩趁热过滤得到MgSO4•7H2O;
(1)在酸解过程中,可以通过升高温度、将固体粉碎、适当提高硫酸溶液的浓度并用玻璃棒搅拌等来加快酸解时的化学反应速率,
故答案为:适当升温;把硼镁泥粉碎、或搅拌、或适当增加硫酸浓度;
(2)溶液中含有Fe2+,具有还原性,可与NaClO发生氧化还原反应,反应的离子方程式为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,生成的Fe3+很容易水解生成Fe(OH)3的离子方程式为Fe3++3H2O═Fe(OH)3+3H+,总反应式为2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+,
故答案为:2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+;
(3)滤渣的成分包括Fe(OH)3、Al(OH)3、MnO2、SiO2及少量微溶的CaSO4,则还有SiO2、CaSO4,
故答案为:SiO2、CaSO4;
(4)有温度对硫酸镁、硫酸钙的溶解度影响,温度越高,硫酸钙溶解度越小,可以采用蒸发浓缩,趁热过滤方法除去硫酸钙,“操作I”是将滤液继续蒸发浓缩,冷却结晶,通过过滤洗涤得到MgSO4•7H2O,
故答案为:趁热过滤;过滤洗涤;
(5)100g硼镁泥中氧化镁的物质的量为=$\frac{100g×40%}{40g/mol}$=1mol,根据镁原子守恒,生成MgSO4•7H2O的物质的量为1mol,质量为246g/mol×1mol=246g,MgSO4•7H2O的产率为$\frac{172.2g}{246g}$×100%=70%,
故答案为:70%;
(6)金属镁可用于自然水体中铁件的电化学防腐有二种方式,一是与铁形成原电池,镁为负极,另一种是电解池,铁连接电源的负极,镁作阳极,具体连接方式为 和
和 ,
,
故答案为: 和
和 .
.
点评 本题考查了从硼镁泥中提取MgSO4•7H2O的方法,涉及配制一定物质的量浓度的溶液的仪器选择、铁离子检验方法、物质分离的方法,产率计算等,侧重考查学生分析问题能力,题目难度较大.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题

| A. | 此装置为原电池,铜片上有气泡产生 | |
| B. | 铜片质量逐渐减少 | |
| C. | 电流从锌片经导线流向铜片 | |
| D. | 氢离子在铜片表面被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定含有乙烯 | |
| B. | 可能为等物质的量甲烷和丙烯的混合物 | |
| C. | 可能为乙烷和丙烷的混合物 | |
| D. | 一定为乙烯和甲烷的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸与醇反应一定能生成酯,且酯化反应是可逆反应 | |
| B. | CO2通入饱和苯酚钠溶液,用分液法可以得到苯酚 | |
| C. | 有机物 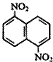 的n溴代物的同分异构体的数目与m溴代物的同分异构体的数目相等,则m、n一定满足的关系式m+n=6 的n溴代物的同分异构体的数目与m溴代物的同分异构体的数目相等,则m、n一定满足的关系式m+n=6 | |
| D. | 等物质的量的烃或烃的含氧衍生物A和B完全燃烧时,消耗氧气的量相等.则A和B的分子量相差可能为18n或44n(n为正整数) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度(mol/L) | 2.0 | 1.0 | 0 |
| 平衡浓度(mol/L) | c1 | c2 | 0.4 |
| A. | 10 min内,v(Cl2)=0.04 mol/(L•min) | |
| B. | 当容器中Cl2为1.2 mol时,反应达到平衡 | |
| C. | 升高温度(T1<T2),反应的平衡常数减小,平衡时PCl3的$\frac{△n({T}_{1})}{△n({T}_{2})}$<1 | |
| D. | 平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S,HCl,PH3的热稳定性由弱到强 | |
| B. | 物质的量浓度相等的NaCl,MgCl2,AlCl3三种溶液的pH由小到大 | |
| C. | 等质量的甲烷、乙烯、乙炔充分燃烧,所耗用氧气的量由少到多 | |
| D. | CH3CH2OH,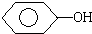 ,CH3COOH的酸性由弱到强 ,CH3COOH的酸性由弱到强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com