
| A. | 铁片与稀盐酸制取氢气时,加入NaNO3固体或Na2SO4固体都不影响生成氢气的速率 | |
| B. | 等质量的锌片分别与同体积、同物质的量浓度的盐酸、硫酸反应,反应速率不相等 | |
| C. | SO2的催化氧化是一个放热反应,所以升高温度,反应速率减慢 | |
| D. | 加入反应物,单位体积内活化分子百分数增大,化学反应速率增大 |
分析 A.加入硝酸钠,生成NO气体,不生成氢气;
B.同物质的量浓度的盐酸、硫酸,硫酸中氢离子浓度较大;
C.升高温度,增大反应速率;
D.加入反应物,单位体积内活化分子百分数不变.
解答 解:A.硝酸根离子在酸性条件下具有强氧化性,加入硝酸钠,生成NO气体,不生成氢气,故A错误;
B.硫酸为二元酸,同物质的量浓度的盐酸、硫酸,硫酸中氢离子浓度较大,故B正确;
C.升高温度,增大活化分子百分数,增大反应速率,与吸热反应、放热反应无关,故C错误;
D.加入反应物,单位体积内活化分子百分数不变,但浓度增大,故D错误.
故选B.
点评 本题考查化学反应速率的影响因素,为高频考点,把握习题中的信息及浓度对反应速率的影响为解答的关键,注重基础知识的考查,加NaNO3固体为解答的易错点,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液分层,上层无色,下层紫红色 | B. | 溶液不分层 | ||
| C. | 溶液分层,上层紫红色,下层无色 | D. | 溶液分层,上层黄色,下层紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图I中,甲、乙的平衡常数分别为K1、K2,则K1=K2 | |
| B. | 图Ⅱ中,平衡状态甲与乙相比,平衡状态甲的反应物转化率低 | |
| C. | 图Ⅱ中,t时间是增大了压强 | |
| D. | 图Ⅲ是反应分别在甲、乙条件下达到平衡,说明甲温度高于乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LNO与CO2的混合气体中含有O原子数为3NA | |
| B. | 0.1mol NH3溶于足量水中(不考虑氨气挥发),溶液中N原子的数目为0.1NA | |
| C. | 0.1molN2与足量的H2反应,转移的电子数是0.6NA | |
| D. | 58.5 g的NaCl固体中含有NA个氯化钠分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率理念可指导怎样在一定时间内快出产品 | |
| B. | 化学平衡理念可指导怎样使用有限原料多出产品 | |
| C. | 化学反应速率理论可指导怎样提高原料的转化率 | |
| D. | 用速率理论和平衡理论都可提高化工生产的综合经济效益 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若起始加入2molN2和6molH2发生反应,则平衡时N2和H2的转化率相同 | |
| B. | 该反应采用高温条件,有利于提高NH3的产率,从而提高生产效率 | |
| C. | 若起始加入2molN2和6molH2发生反应,平衡时测得反应共放热46kJ,则N2的平衡转化率为50% | |
| D. | 若平衡时保持其它条件不变,压缩容器体积,则平衡正向移动,N2的浓度减小,NH3的浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Fe3++3OH-.
Fe3++3OH-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)按已知的原子结构规律,27号元素在周期表中的位置是第四周期第Ⅷ族,其价电子的轨道排布图为
(1)按已知的原子结构规律,27号元素在周期表中的位置是第四周期第Ⅷ族,其价电子的轨道排布图为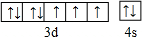 .
. ),则配合物[Pt(en)2]Cl4中心离子的配位原子数为4.
),则配合物[Pt(en)2]Cl4中心离子的配位原子数为4.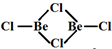 sp2
sp2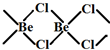 sp3
sp3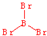

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com