
【题目】A、B、C、D、E 代表五种元素。请填空:
(1)A 元素基态原子的最外层有 3 个未成对电子,次外层有 2 个电子,其元素符号为_____, 电子排布图为_____,原子核外电子的运动状态有_____种。
(2)B 元素的-2 价离子和 C 元素的+1 价离子的电子层结构都与氩原子的相同,B 的原子结构 示意图为_____,B、C 所形成的化合物的电子式为_____。
(3)D 元素的+3 价离子的 3d 能级为半充满状态,D 的元素名称为________,其基态原子的所有 电子占有________个原子轨道。
(4)E 元素基态原子的 M 层为全充满状态,N 层没有成对电子,只有一个未成对电子,则 E 的基态原子的电子有 ________________个 伸 展 方 向 ,其基态原子的电子排布式 为_________________________ ,E +的外围电子排布图为_____________________。
【答案】N ![]() 7
7 ![]()
![]() 铁 15 9 [Ar]3d104s1
铁 15 9 [Ar]3d104s1 ![]()
【解析】
(1)基态原子的最外层有3个未成对电子,次外层有2个电子的元素符号为N;
(2)B元素的负一2离子和C元素的+1价离子的电子层结构都与氩相同,则B是S元素,C是K元素;
(3)由于d轨道最多容纳10个电子,所以当3d亚层为半充满时,D元素的+3离子的核外电子数是23,则该元素的原子序数是23+3=26,D 元素为Fe;
(4)元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,则E为Cu。
(1)基态原子的最外层有3个未成对电子,次外层有2个电子的元素符号为N,其电子排布式为1s22s22p3,电子排布图为![]() ,原子核外电子的运动状态有7种,故答案为:N;
,原子核外电子的运动状态有7种,故答案为:N;![]() ;7;
;7;
(2)B元素的负一2离子和C元素的+1价离子的电子层结构都与氩相同,所以B是S元素,C是K元素,S的原子结构 示意图为![]() ,S、K所形成的化合物为K2S,K2S的电子式为
,S、K所形成的化合物为K2S,K2S的电子式为![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(3)由于d轨道最多容纳10个电子,所以当3d亚层为半充满时,D 元素的+3离子的核外电子数是23,则该元素的原子序数是23+3=26,D 元素为铁,基态原子的电子排布式为1s22s22p63s23p63d64s2,所有电子占有15个原子轨道,故答案为:铁;15;
(4)元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,则E为Cu,
其电子排布式为:1s22s22p63s23p63d104s1或[Ar]3d104s1,涉及4个s轨道、2个p轨道和1个d轨道,因此其核外电子云(轨道)的伸展方向有9个,Cu+的外围电子排布为:1s22s22p63s23p6
3d10,外围电子排布图为![]() ,故答案为:9;1s22s22p63s23p63d104s1或[Ar]3d104s1;
,故答案为:9;1s22s22p63s23p63d104s1或[Ar]3d104s1;![]() 。
。


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案科目:高中化学 来源: 题型:
【题目】下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25 ℃)。
电解质 | 平衡方程式 | 平衡常数K | Ksp |
CH3COOH | CH3COOH | 1.76×10-5 | |
H2CO3 | H2CO3 HCO3- | K1=4.31×10-4 K2=5.61×10-11 | |
C6H5OH | C6H5OH | 1.1×10-10 | |
H3PO4 | H3PO4 H2PO4- HPO42- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 | |
NH3·H2O | NH3·H2O | 1.76×10-5 | |
BaSO4 | BaSO4(s) | 1.0×10-10 | |
BaCO3 | BaCO3(s) | 2.5×10-9 |
回答下列问题:
(1)由上表分析,若①CH3COOH,②HCO3-,③C6H5OH,④H2PO4-均可看做酸,则它们酸性最强的是_______(填编号)。
(2)向C6H5ONa溶液中通入少量CO2,写出反应的离子方程式_____________________。
(3)25 ℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)______c(NH4+)(填“>”、“=”或“<”)。
(4)25 ℃时,向10 mL 0.01 mol·L-1苯酚(C6H5OH)溶液中滴加V mL 0.01 mol·L-1氨水,混合液中粒子浓度关系正确的是________。
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
C.V=10时,混合液中水的电离程度小于10 mL 0.01 mol·L-1苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+2c(NH4+)=c(C6H5O-)+c(C6H5OH)
(5)Ⅰ.如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:

①T2温度时Ksp(BaSO4)=__________;
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法不正确的是________。
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a,b之间的某一点(不含a,b)
D.升温可使溶液由b点变为d点
Ⅱ.现有0.35mol的BaSO4沉淀,每次用1 L饱和Na2CO3溶液(物质的量浓度为1.7 mol·L-1)处理。若使BaSO4中的SO42-全部转化到溶液中,需要反复处理________次。[提示:BaSO4(s)+CO32-(aq)![]() BaCO3(s)+SO42-(aq)]
BaCO3(s)+SO42-(aq)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯NOCl可用于合成清洁剂等。它可用Cl2与NO在常温常压下合成:它的熔点为-64.5℃,沸点为-5.5℃,常温下是黄色的有毒气体,遇水易水解。 请按要求回答下列相关问题:
(1)过量铁屑和稀硝酸充分反应制备NO的离子方程式为:______________________。
(2)制备NOCl的装置如下图所示,连接顺序为:a→_________________________(按气流自左向右方向,用小写字母表示)。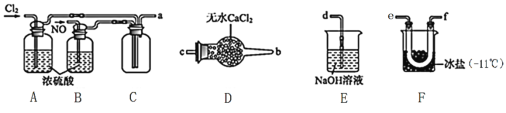
①装置A和B作用是①干燥NO和Cl2,②___________________________________________。
②装置D的作用是______________________________________。
③装置E中NOCl发生反应的化学方程式为________________。
(3)工业生产过程中NO尾气处理方法有多种,其中间接电化学法,其原理如图所示:

该过程中阴极的电极反应式为:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 反应 2Mg+CO2 ![]() 2MgO+C△H<0 从熵变角度看,可自发进行
2MgO+C△H<0 从熵变角度看,可自发进行
B. 在密闭容器发生可逆反应:2NO(g)+2CO(g)N2(g)+2CO2(g)△H=-113.0kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,△H 变小
C. 根据 HClO 的 Ka=3.0×108,H2CO3 的 Ka1=4.3×107,Ka2=5.6×1011,可推测相同状况 下,等浓度的 NaClO 与 Na2CO3 溶液中,pH 前者小于后者
D. 已知:Ksp(AgCl)=1.8×1010,Ksp(Ag2CrO4)=2.0×1012,将等体积浓度为1.0×10﹣4mol/L 的 AgNO3 溶液滴入到浓度均为 1.0×10﹣4mol/L 的 KCl 和 K2CrO4 的混合溶液中产生两种不同沉淀,且 Ag2CrO4 沉淀先产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2是一种清洁能源。在冶金、电力、材料等领域应用广泛。请回答下列问题:
(1)某科研团队利用透氧膜获得N2、H2的工作原理如图甲所示(空气中N2与O2的物质的量之比按4:1计)。上述过程中,膜I侧所得气体的物质的量之比n(H2):n(N2)=3:1,则CH4、H2O与O2反应的化学方程式为______________________。

(2)用H2和CO合成甲醇的热化学方程式为CO(g)+2H2(g) ![]() CH3OH (g) △H1。已知:CO2(g)+3H2(g)==CH3OH(g)+H2O(g) △H2=-49.0kJ·mol-1;CO(g)+H2O(g)==CO2(g)+H2(g) △H3=-41.1k J·mol-1.则△H1=___________ k J·mol-1。
CH3OH (g) △H1。已知:CO2(g)+3H2(g)==CH3OH(g)+H2O(g) △H2=-49.0kJ·mol-1;CO(g)+H2O(g)==CO2(g)+H2(g) △H3=-41.1k J·mol-1.则△H1=___________ k J·mol-1。
(3)向容积可变的密闭容器中充入1 mol CO和2.2molH2,在恒温恒压条件下发生反应CO(g)+2H2(g)![]() CH3OH(g),平衡时,CO的转化率[α(CO)]随温度、压强的变化情况如图乙所示。
CH3OH(g),平衡时,CO的转化率[α(CO)]随温度、压强的变化情况如图乙所示。

①压强:p1___________(填“>”<”或“=”)p2。
②M点时,H2的转化率为___________(计算结果精确到0.1%),该反应的平衡常数Kp=___________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③不同温度下,该反应的平衡常数的对数值(lgK)如图丙所示,其中,A点为506K时平衡常数的对数值,则B、C、D、E四点中能正确表示该反应的lgK与温度(T)的关系的是___________。
(4)H2还原NO的反应为2NO(g)+2H2(g)![]() N2(g)+2H2O(1),实验测得反应速率的表达式为v=kcm(NO)·cn(H2)(k是速率常数,只与温度有关)
N2(g)+2H2O(1),实验测得反应速率的表达式为v=kcm(NO)·cn(H2)(k是速率常数,只与温度有关)
①某温度下,反应速率与反应物浓度的变化关系如下表所示。
编号 | c(H2)/(mol/L) | c(NO)/(mol/L) | v/(mol/Lmin) |
1 | 0.10 | 0.10 | 0.414k |
2 | 0.10 | 0.20 | 1.656k |
3 | 0.50 | 0.10 | 2.070k |
由表中数据可知,m=___________,n=___________。
②上述反应分两步进行:i.2NO(g)+H2(g)==N2(g)+H2O2(1)(慢反应);ii.H2O2(1)+H2(g)==2H2O(1)(快反应)。下列叙述正确的是___________(填字母)
A.H2O2是该反应的催化剂
B.反应i的活化能较高
C.总反应速率由反应ii的速率决定
D.反应i中NO和H2的碰撞仅部分有效
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3 作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的 催化剂研究曾被列入国家 863 计划。
(1)催化剂常具有较强的选择性,即专一性。已知:反应 I :4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g)△H= 905.0 kJ·mol-1 反应 II : 4NH3(g)+3O2(g)
4NO(g) +6H2O(g)△H= 905.0 kJ·mol-1 反应 II : 4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H= 1266.6 kJ·mol-1 写出 NO 分解生成 N2 与 O2 的热化学方程式_________。
2N2(g) +6H2O(g) △H= 1266.6 kJ·mol-1 写出 NO 分解生成 N2 与 O2 的热化学方程式_________。
(2)在恒温恒容装置中充入一定量的 NH3 和 O2,在某催化剂的作用下进行反应 I ,测得不同时 间的 NH3 和 O2,的浓度如下表:
时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
c(NH3)/mol·L1 | 1.00 | 0.36 | 0.12 | 0.08 | 0.072 | 0.072 |
c(O2)/mol L1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
则下列有关叙述中正确的是_____。
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内 4v 正(NH3) =6v 逆(H2O)时,说明反应已达平衡
C.当容器内n(NO)/n(NH3)=1 时,说明反应已达平衡
D.前 10 分钟内的平均速率 v( NO)=0.088 mol·L-1·min-1
(3)制备催化剂时常产生一定的废液,工业上常利用氢硫酸检测和除去废液中的 Cu2+。 已知:25℃时,K1(H2S) =1.3×107,K2(H2S) =7.1×1015,Ksp(CuS) =8.5×1045
①在计算溶液中的离子浓度时,涉及弱酸的电离通常要进行近似处理。则 0.lmol L1 氢硫 酸的 pH≈______(取近似整数)。
②某同学通过近似计算发现 0.lmol L1 氢硫酸与 0.0lmol L1 氢硫酸中的 c(S2)相等,而且 等于_____mol·L1
③已知,某废液接近于中性,若加入适量的氢硫酸,当废液中 c(Cu2+) >_____mol·L1(计算 结果保留两位有效数字),就会产生 CuS 沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项中所示的物质间转化均能实现的是
A. Ca(OH)2![]() Ca(ClO)2
Ca(ClO)2![]() HClO
HClO
B. SiO2![]() Na2SiO3
Na2SiO3![]() H2SiO3
H2SiO3
C. FeS2![]() SO2
SO2![]() (NH4)2SO4
(NH4)2SO4
D. 饱和NaCl溶液![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。电解一段时间后,若在电解池中C极一侧出来的气体无色无味,D极一侧出来的气体呈黄绿色有刺激性气味。请回答以下问题:

(1)已知铅蓄电池在放电时发生的反应:Pb+PbO2+4H++2SO42-=2PbSO4+2H2O,则A极的电极反应为___________________________;
(2)电解饱和食盐水的离子反应方程式是__________________;
(3)电极C的电极反应是_____________________________________________;
(4)电解时为防止两种气体产物混合,用阳离子交换膜做隔膜。则电解时Na+从______极区移向_____极区(填“C”或“D”);
(5)若电路上有0.2mol电子的电量通过,则铅蓄电池中消耗硫酸_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行以下可逆反应:M(g)+N(g)![]() P(g)+2L在不同的条件下P的百分含量P %的变化情况如下图,则该反应( )
P(g)+2L在不同的条件下P的百分含量P %的变化情况如下图,则该反应( )

A. 正反应放热,L是固体
B. 正反应放热,L是气体
C. 正反应吸热,L是气体
D. 正反应放热,L是固体或气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com