
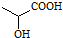
 ,下列有关说法正确的是( )
,下列有关说法正确的是( )| A. | 葡萄糖和乳酸含有相同的官能团 | |
| B. | 向葡萄糖溶液加入氢氧化铜悬浊液,加热一定有砖红色沉淀生成 | |
| C. | 乳酸能发生催化氧化、加成和取代反应 | |
| D. | 分子式C3H6O3,且含有羟基、羧基的有机物共有2种 |
分析 该物质分子中含有醇羟基和羧基,具有醇和羧酸性质,能发生取代反应、消去反应、氧化反应、酯化反应、中和反应等,据此分析解答.
解答 解:A.葡萄糖为多羟基醛,含有醇羟基和醛基,乳酸中含有醇羟基、羧基,二者官能团不完全相同,故A错误;
B.葡萄糖和新制氢氧化铜悬浊液在加热条件下发生氧化反应才能生成砖红色沉淀,否则不生成砖红色沉淀,故B错误;
C.乳酸不含碳碳不饱和键、醛基、羰基、苯环等结构,不能发生加成反应,故C错误;
D.分子式C3H6O3,且含有羟基、羧基的有机物有HOCH2CH2COOH、CH3CH(OH)COOH,共有2种,故D正确;
故选D.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断能力,涉及同分异构体、官能团判断、物质性质等知识点,明确官能团及其性质关系是解本题关键,注意酯基中碳氧双键不能发生加成反应,为易错点.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
1 mol Na2O2晶体和1 mol Na2O的晶体中阴离子的个数比较,前者和后者的关系是( )
A.前者大 B.前者小 C.相等 D.不能肯定
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
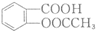 和
和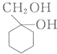 的流程路线.
的流程路线.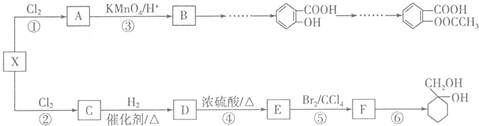
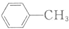 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$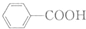
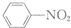 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$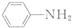 (苯胺,易被氧化)
(苯胺,易被氧化)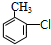 .
.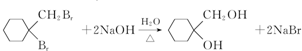 .
.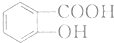 有多种同分异构体,写出符合下列条件的同分异构体的结构简式
有多种同分异构体,写出符合下列条件的同分异构体的结构简式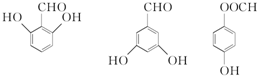 (任写一种).
(任写一种).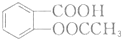 的结构与性质,说法正确的是AD.
的结构与性质,说法正确的是AD.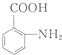 最合理的方案,请在答题纸的方框中表示.
最合理的方案,请在答题纸的方框中表示.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | O=O | C-O | O-H | C-H |
| 键能(kJ•mol-1) | 498 | 351 | 465 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
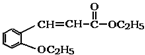 )是合成高分子化合物M的单体,H可以通过有机物A(分子式为C7H8O)和丙酮为原料来进行合成,E为中间产物(结构简式为
)是合成高分子化合物M的单体,H可以通过有机物A(分子式为C7H8O)和丙酮为原料来进行合成,E为中间产物(结构简式为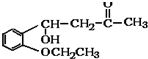 )其合成路线如图:
)其合成路线如图:
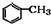 $→_{催化剂}^{O_{2}}$
$→_{催化剂}^{O_{2}}$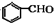
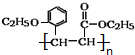 .
.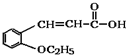 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$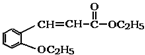 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同质量、不同密度的N2和CO | B. | 同密度、同体积的H2和N2 | ||
| C. | 同体积、同密度的C2H4和C3H6 | D. | 同温度、同体积的N2O和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
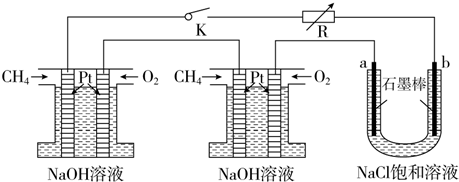
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com