
铁及其化合物与生产、生活关系密切。
右图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
①该电化腐蚀称为____________。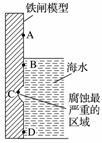
②图中A、B、C、D四个区域,生成铁锈最多的是__________(填字母)。
科目:高中化学 来源: 题型:
由Ca3(PO4)2 、SiO2 、焦炭等为原料生产硅胶(SiO2·nH2O)、磷、磷酸及CH3OH,下列工艺过程原料综合利用率高,废弃物少。
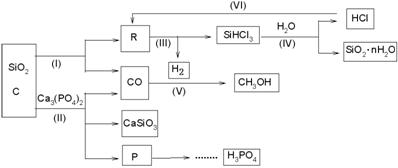
(1)上述反应中,属于置换反应的是 [选填:(Ⅰ)、(Ⅱ)、(Ⅲ)、(Ⅳ)、(Ⅴ)]
(2)高温下进行的反应Ⅱ的化学方程式为: ;
固体废弃物CaSiO3可用于 。
(3)反应Ⅲ需在隔绝氧气和无水条件下进行,其原因是 。
(4)CH3OH可用作燃料电池的燃料,在强酸性介质中,负极的电极反应式为 。
(5)指出(VI)这一环节在工业生产上的意义
(6)写出由P→H3PO4 有关反应式
①
②
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH。则下列说法正确的是( )
A.电解过程中阴极没有气体生成
B.电解过程中转移的电子的物质的量为0.4 mol
C.原CuSO4溶液的浓度为0.1 mol·L-1
D.电解过程中阳极收集到的气体体积为1.12 L(标况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与金属腐蚀有关的说法,正确的是( )
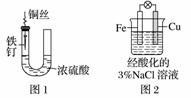
A.图1中,铁钉易被腐蚀
B.图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现
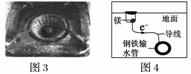
C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀
D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
离子液体是一种室温熔融盐,为非水体系。由有机阳离子、Al2Cl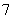 和AlCl
和AlCl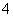 组成的离子液体作电解液时,可在钢制品上电镀铝。
组成的离子液体作电解液时,可在钢制品上电镀铝。
钢制品应接电源的________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为________________________________。若改用AlCl3水溶液作电解液,则阴极产物为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
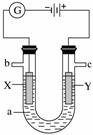
(1)若X、Y是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞,则:
①电解池中X极上的电极反应式是___________________________________________,
在X极附近观察到的现象是__________________________________________。
②Y电极上的电极反应式是__________________________________________________,
检验该电极反应产物的方法是_________________________________________________。
(2)若用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是_____________________________________________,
电极反应式是______________________________________。
②Y电极的材料是__________________________________________________,
电极反应式是________________________________________________
(说明:杂质发生的电极反应不必写出)。
③当电路中有0.04 mol电子通过时,阴极增重________________________ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
锗(Ge)是第四周期第 ⅣA 元素,处于周期表中金属区与非金属区的交界线上,下列叙述正确的是
A.锗是一种金属性很强的元素 B.锗的单质具有半导体的性能
C.锗化氢(GeH4)稳定性很强 D.锗酸(H4GeO4)是难溶于水的强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
银铜合金广泛用于航空工业,从切割废料中回收银并制备铜化工产品的工艺如下:
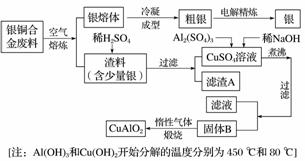
(1)电解精炼银时,阴极反应式为_______________________________;
滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学反应方程式为____________。
(2)固体混合物B的组成为__________;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为____________。
(3)完成煅烧过程中一个反应的化学方程式:____CuO+____Al2O3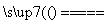 ____CuAlO2+________↑。
____CuAlO2+________↑。
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0 kg废料中的铜可完全转化为________ mol CuAlO2,至少需要 1.0 mol·L-1的Al2(SO4)3溶液________ L。
(5)CuSO4溶液也可用于制备胆矾,其基本操作是________、过滤、洗涤和干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com