
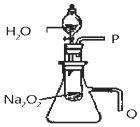
·ÖĪö £Ø1£©øßĆĢĖį¼ŲŹĒ½šŹōŃōĄė×ÓŗĶĖįøłŅõĄė×Ó¹¹³ÉµÄ»ÆŗĻĪļ£¬Ė®ČÜŅŗÖŠµ¼µēŹōÓŚµē½āÖŹ£»
£Ø2£©øßĆĢĖį¼ŲĖ®ČÜŅŗÄܵ¼µēŹĒŅņĪŖøßĆĢĖį¼ŲĖ®ČÜŅŗÖŠµēĄė³ö×ŌÓÉŅĘ¶ÆµÄĄė×Ó£»
£Ø3£©øßĆĢĖį¼ŲŗĶÅØŃĪĖį·“Ӧɜ³ÉĀČĘų£¬·“Ó¦ÖŠÅØŃĪĖįĻŌŹ¾ĮĖĖįŠŌŗĶ»¹ŌŠŌ£»
£Ø4£©ĆĢŌŖĖŲ»ÆŗĻ¼Ū+7¼Ū±ä»ÆĪŖ+2¼Ū£¬Ģ¼ŌŖĖŲ»ÆŗĻ¼Ū+3¼Ū±ä»ÆĪŖ+4¼Ū£¬½įŗĻµē×ÓŹŲŗć”¢Ō×ÓŹŲŗćÅäĘ½ŹéŠ“Ąė×Ó·½³ĢŹ½£®
½ā“š ½ā£ŗ£Ø1£©øßĆĢĖį¼ŲŹĒ½šŹōŃōĄė×ÓŗĶĖįøłŅõĄė×Ó¹¹³ÉµÄ»ÆŗĻĪļ£¬Ė®ČÜŅŗÖŠµ¼µēŹōÓŚµē½āÖŹ£¬¹ŹŃ”bce£¬¹Ź“š°øĪŖ£ŗbce£»
£Ø2£©øßĆĢĖį¼ŲĖ®ČÜŅŗÄܵ¼µē£¬ĘäŌŅņŹĒĖ®ČÜŅŗÖŠµēĄė³ö×ŌÓÉŅĘ¶ÆĄė×Óµ¼µē£¬µēĄė·½³ĢŹ½ĪŖ£ŗKMnO4=K++MnO4-£¬¹Ź“š°øĪŖ£ŗKMnO4=K++MnO4-£»
£Ø3£©ŹµŃéŹŅÖŠ
¼øßĆĢĖį¼Ų“śĢęMn02ÓėÅØŃĪĖįŌŚ²»¼ÓČȵÄĢõ¼žĻĀÖʱøCl2£®·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗ2MnO4-+10Cl-+16H+=5Cl2”ü+2Mn2++8H2O£¬ĀČŌŖĖŲ»ÆŗĻ¼Ū±ä»Æ·ÖĪö£¬øĆ·“Ó¦ÖŠ£¬ÅØŃĪĖįµÄ×÷ÓĆŹĒĖįŠŌ”¢»¹ŌŠŌ£¬
¹Ź“š°øĪŖ£ŗ2MnO4-+10Cl-+16H+=5Cl2”ü+2Mn2++8H2O£»ĖįŠŌ”¢»¹ŌŠŌ£»
£Ø4£©ĆĢŌŖĖŲ»ÆŗĻ¼Ū+7¼Ū±ä»ÆĪŖ+2¼Ū£¬µē×Ó×ŖŅĘ5£¬Ģ¼ŌŖĖŲ»ÆŗĻ¼Ū+3¼Ū±ä»ÆĪŖ+4¼Ū£¬µē×Ó×ŖŅĘ1£¬½įŗĻµē×ÓŹŲŗć”¢Ō×ÓŹŲŗćÅäĘ½ŹéŠ“Ąė×Ó·½³ĢŹ½ĪŖ£ŗ2Mn04-+5H2C204+6H+=10CO2”ü+2Mn2++8H2O£¬
¹Ź“š°øĪŖ£ŗ2”¢5”¢6”¢10”¢2”¢8H2O£®
µćĘĄ ±¾Ģāæ¼²éĮĖĪļÖŹ·ÖĄą”¢Ńõ»Æ»¹Ō·“Ó¦”¢Ąė×Ó·½³ĢŹ½ŹéŠ“£¬ÕĘĪÕ»ł“”ŹĒ½āĢā¹Ų¼ü£¬ĢāÄæÄѶČÖŠµČ£®


 æŚĖćŠÄĖćĖŁĖćÓ¦ÓĆĢāĻµĮŠ“š°ø
æŚĖćŠÄĖćĖŁĖćÓ¦ÓĆĢāĻµĮŠ“š°ø Ķ¬²½ĶŲÕ¹ŌĶĮĻµĮŠ“š°ø
Ķ¬²½ĶŲÕ¹ŌĶĮĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
| ĪĀ¶Č£Ø”ę£© | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| Ę½ŗā×ÜŃ¹Ēæ£ØkPa£© | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| Ę½ŗāĘųĢå×ÜÅØ¶Č £Ø”Į10-3mol/L£© | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | K+”¢Cl-”¢NO3-”¢Fe2+ | B£® | K+”¢Mg2+”¢I-”¢SO42- | ||
| C£® | K+”¢Ca2+”¢Cl-”¢HCO3- | D£® | Na+”¢Cl-”¢NO3-”¢S042- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
 ŹµŃé·ØŹĒ»ÆѧÖŲŅŖµÄŃŠ¾æĪļÖŹŠŌÖŹµÄ»ł±¾·½·Ø£®Ä³»Æѧъ¾æŠ”×é½ųŠŠĮĖČēĻĀŹµŃ飬Ēė»Ų“šĪŹĢā£®
ŹµŃé·ØŹĒ»ÆѧÖŲŅŖµÄŃŠ¾æĪļÖŹŠŌÖŹµÄ»ł±¾·½·Ø£®Ä³»Æѧъ¾æŠ”×é½ųŠŠĮĖČēĻĀŹµŃ飬Ēė»Ų“šĪŹĢā£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| t/min | 2 | 4 | 7 | 9 |
| n£ØY£©/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A£® | øĆĪĀ¶ČĻĀ“Ė·“Ó¦µÄĘ½ŗā³£ŹżK=1.44 | |
| B£® | ĘäĖūĢõ¼ž²»±ä£¬½µµĶĪĀ¶Č£¬·“Ó¦“ļµ½ŠĀĘ½ŗāĒ°¦Ķ£ØÄę£©£¾¦Ķ£ØÕż£© | |
| C£® | ĘäĖūĢõ¼ž²»±ä£¬ŌŁ³äČė0.2molZ£¬Ę½ŗāŹ±XµÄĢå»ż·ÖŹżŌö“ó | |
| D£® | 0”«2minµÄĘ½¾łĖŁĀŹ¦Ķ£ØZ£©=2.0”Į10-3mol•L-1•min-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 2gH2ÖŠµÄŌ×ÓŹżÄæĪŖNA | |
| B£® | 64gSO2ÖŠµÄŌ×ÓŹżÄæĪŖ3NA | |
| C£® | 1mol/LNaOHČÜŅŗÖŠµÄNa+µÄŹżÄæĪŖNA | |
| D£® | ³£ĪĀ³£ĻĀ£¬11.2LCl2ÖŠµÄ·Ö×ÓŹżÄæĪŖ0.5NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
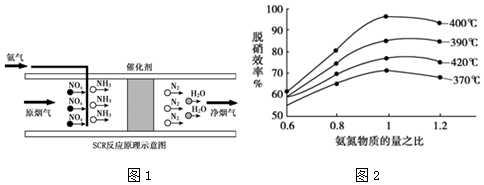
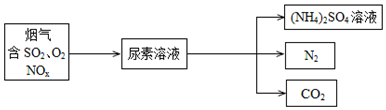
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | n£ØH2CO3£©ŗĶc£ØHCO3-£©Ö®ŗĶĪŖ1molµÄNaHCO3ČÜŅŗÖŠ£¬ŗ¬ÓŠNa+ŹżÄæĪŖNA | |
| B£® | 5g 21HŗĶ31HµÄ»ģŗĻĪļ·¢ÉśČČŗĖ¾Ū±ä·“Ó¦£ŗ21H+31H”ś42He+10n£¬¾»²śÉśµÄÖŠ×Ó£Ø10n£©ŹżĪŖNA | |
| C£® | 1L 0.1mol/LŅŅ“¼ČÜŅŗÖŠ“ęŌŚµÄ¹²¼Ū¼ü×ÜŹżĪŖ0.8NA | |
| D£® | 56g ĢśÓė×ćĮæĀČĘų·“Ó¦£¬ĀČĘų¹²µĆµ½3NAøöµē×Ó |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com