
 回答下列问题:
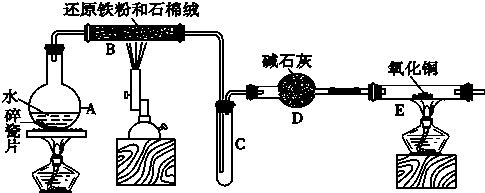
回答下列问题:分析 A.工业上,向500℃~600℃的铁屑中通入氯气生产无水氯化铁;向炽热铁屑中通入氯化氢生产无水氯化亚铁,A装置:烧瓶中反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,制取的氯气中含有水蒸气,B装置:容器中装有浓硫酸,浓硫酸有吸水性,且不和氯气反应,用浓硫酸干燥氯气;C装置:氯气与铁在加热条件下生成氯化铁,反应方程式为:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3,氯气有毒不能排放到空气中,D装置:吸收尾气氯气,
(1)实验室利用二氧化锰与浓盐酸加热反应制取氯气,浓硫酸可以吸收水蒸气干燥氯气;
(2)制取无水氯化亚铁,需要HCl气体,尾气的成分是剩余HCl和生成的氢气,HCl极易溶解于水,氢气不能溶于水;
(3)检验氯化铁常用硫氰化钾溶液,若要制取纯净的FeCl2,需先点燃A处的酒精灯排除装置中的空气,据此解答即可;
B.铜和铝插入浓HNO3中组成原电池,开始阶段,铝的还原性强于铜,铝做原电池的负极,发生的原电池反应为铝与硝酸的反应,随着反应的进行,铝被钝化,铜做负极,发生的原电池反应是铜与浓硝酸反应,据此分析解答.
解答 解:A.(1)制取无水氯化铁的实验中,A装置制取的是氯气,实验室常用浓盐酸与二氧化锰加热制取,反应的离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,制取的氯气中含有水蒸气,装置B的作用是干燥氯气,常用浓硫酸,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;浓硫酸;
(2)制取无水氯化亚铁,需要HCl气体,故A装置制取的是HCl,反应方程式为:Fe+2HCl$\frac{\underline{\;\;△\;\;}}{\;}$FeCl2+H2↑,由于HCl极易溶于水,故若仍然采用D装置进行尾气处理,很容易造成倒吸,且氢气不溶于水,不利于氢气的吸收,排放到空气中氢气易燃,造成安全隐患,
故答案为:HCl;易发生倒吸;可燃性气体H2不能被吸收;
(3)检验氯化铁溶液中铁离子,常用硫氰化钾溶液,若要制取纯净的FeCl2,需先通入氯化氢气体排净装置中的空气,防止在加热时Fe与O2反应,故先点燃A处的酒精灯,再点燃C处的酒精灯,
故答案为:KSCN溶液;通入氯化氢赶走装置中的空气;点燃C处的酒精灯;
B.铜和铝插入浓HNO3中组成原电池,开始阶段,铝的还原性强于铜,铝做原电池的负极,发生的原电池反应为铝与硝酸的反应,此时氢离子向铜电极方向移动,电池的正极反应式为2H++NO3-+e-=NO2+H2O,随着反应的进行,铝被钝化,铜做负极,发生的原电池反应是铜与浓硝酸反应,电流方向相反,
故答案为:Cu,2H++NO3--e-=NO2+H2O,随着反应进行铝表面钝化形成氧化膜阻碍反应进行,铜做负极反应,电流方向相反;
点评 本题以氯化铁以及氯化亚铁的制取为载体,考查的是实验室中氯气的制取方法、常见尾气的处理方法以及铁离子的检验、原电池原理分析等,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
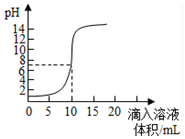
| A. | 原来盐酸的物质的量浓度为0.1mol•L-1 | |
| B. | 可以选择红色石蕊作为指示剂 | |
| C. | 氢氧化钠的物质的量浓度为0.1mol•L-1 | |
| D. | pH为7时加入的氢氧化钠的物质的量为0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在该反应中有1 mol H2C2O4参加反应,转移电子总数为6NA | |
| B. | 该反应配平后H+的化学计量数为6 | |
| C. | 该反应右边横线上的产物为OH- | |
| D. | 该反应的氧化剂为H2C2O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
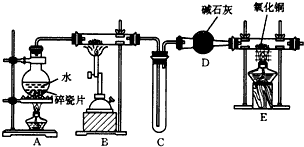
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
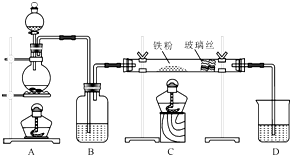 工业上,向500℃~600℃的铁屑中通入氯气生产无水氯化铁(已知炽热铁屑与氯化氢生成氯化亚铁).现用如图所示的装置模拟上述过程进行试验.
工业上,向500℃~600℃的铁屑中通入氯气生产无水氯化铁(已知炽热铁屑与氯化氢生成氯化亚铁).现用如图所示的装置模拟上述过程进行试验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
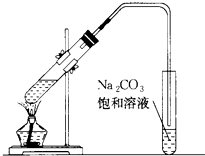 图是实验室制乙酸乙酯的装置.
图是实验室制乙酸乙酯的装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com