
分析 金属铝可以和氢氧化钠之间反应,但是铁不会反应,金属铝、铁可以和盐酸之间反应,根据发生反应的方程式进行计算,实验中会发生的反应:2Al+6HCl=2AlCl3+3H2↑;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;Fe+2HCl═FeCl2+H2↑.
解答 解:乙向样品中加入一定浓度的足量NaOH溶液,只发生反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,收集到6.72L即0.3mol,气体消耗金属铝的物质的量是0.2mol,所以金属铝的物质的量是0.2mol;
甲向样品中加入一定浓度的稀盐酸,样品全部溶解,发生反应:2Al+6HCl=2AlCl3+3H2↑,Fe+2HCl═FeCl2+H2↑,共收集到11.2L即0.5mol气体;
金属铝的物质的量是0.2mol,会产生氢气0.3mol,所以全部的金属铁产生氢气是0.2mol,所以铁的物质的量是0.2mol,
答:样品中铝与铁的物质的量分别是n(Fe)=0.2mol;n(Al)=0.2mol.
点评 本题主要涉及金属铁和铝的化学性质以及根据化学方程式的计算等知识,属于综合知识的考查题,难度不大.


科目:高中化学 来源: 题型:解答题
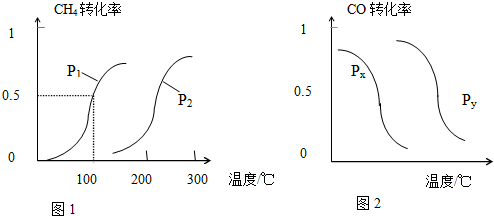
| 实验编号 | T(℃) | n(CO)/n(H2) | P(MPa) |
| 1 | 180 | $\frac{2}{3}$ | 0.1 |
| 2 | n | $\frac{2}{3}$ | 5 |
| 3 | 350 | m | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
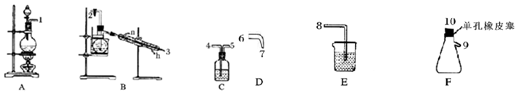
| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 蒸馏中,冷却水应从冷凝管的下口通入,上口流出 | |
| D. | 过滤操作时,漏斗颈下端不能紧靠烧杯内壁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在同温同压下,相同体积的任何气体单质所含的分子数目一定相同 | |
| B. | 1L 0.5mol/L FeCl3溶液完全转化可得0.5NA个Fe(OH)3胶粒 | |
| C. | 标准状况下,22.4L苯含有的分子数为1NA | |
| D. | 在常温常压下,11.2 L氮气所含的原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物理性质 | 制备原理 | 化学性质 |
| 黄色油状液体,熔点为-40℃,沸点为71℃,不溶于冷水,易溶于有机溶剂,密度为1.65g/mL | Cl2与NH4Cl水溶液在低温下反应 | 95℃爆炸,热水中能与水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
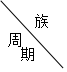 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com