
| 选项 | 实验操作 | 实验目的 |
| A | 向甲酸钠溶液中加新制的Cu(OH)2并加热 | 确定甲酸钠具有醛基性质 |
| B | 加溴水,振荡,过滤除去沉淀 | 除去苯中混有的苯酚 |
| C | 向酒精和水的混合溶液中加入金属钠 | 确定酒精中混有水 |
| D | 将氯乙烷与氢氧化钠溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液 | 检验水解产物中的氯离子 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.含-CHO的物质与新制的Cu(OH)2并加热,生成砖红色沉淀;
B.溴、三溴苯酚均易溶于苯;
C.酒精、水均与Na反应;
D.氯乙烷与氢氧化钠溶液共热,发生水解反应,检验氯离子应在酸性溶液中.
解答 解:A.含-CHO的物质与新制的Cu(OH)2并加热,生成砖红色沉淀,则向甲酸钠溶液中加新制的Cu(OH)2并加热,可检验醛的性质,故A正确;
B.溴、三溴苯酚均易溶于苯,不能除杂,应选NaOH溶液、分液除杂,故B错误;
C.酒精、水均与Na反应,现象相同,利用Na不能鉴别,故C错误;
D.氯乙烷与氢氧化钠溶液共热,发生水解反应,检验氯离子应在酸性溶液中,则应先加酸至酸性再加硝酸银检验,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及有机物的结构与性质、混合物分离提纯、离子检验等,把握物质的性质、混合物分离提纯方法等为解答的关键,注意实验的评价性分析,题目难度不大.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 配制一定物质的量的浓度的溶液时,定容时仰视刻度线会导致所配溶液浓度偏低 | |
| B. | 用托盘天平秤取25.20g NaCl | |
| C. | 用100mL 量筒量取5.2mL 盐酸 | |
| D. | 用浓盐酸配制一定物质的量浓度的稀盐酸,将量取的浓盐酸倒入容量瓶中,加水稀释到刻度线即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释或解决方法 |
| A | 大量的燃煤、燃油是形成雾霾的主要原因, | 发展核能等清洁能源,减少化石燃料的使用 |
| B | “地沟油”是被氧化、分解的油脂,禁止食用 | 采用化学技术处理后代替汽油作燃料 |
| C | 氢氧化钠与氢氟酸都能与硅、二氧化硅反应 | 硅、二氧化硅都具有两性 |
| D | 漂白粉在空气中久置变质是 | 漂白粉中的有效成分与空气中的CO2反应生成CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
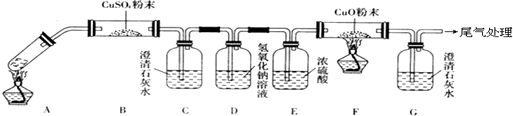
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 (苯胺,易被氧化)
(苯胺,易被氧化) ,其核磁共振氢谱图有4个吸收峰;
,其核磁共振氢谱图有4个吸收峰; ;
; ;
; 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有6种;
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有6种; 的流程:A$→_{Na/△}^{H_{2}}$甲→乙$\stackrel{Br_{2}/CCl_{4}}{→}$
的流程:A$→_{Na/△}^{H_{2}}$甲→乙$\stackrel{Br_{2}/CCl_{4}}{→}$ $→_{△}^{NaOH(aq)}$
$→_{△}^{NaOH(aq)}$
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
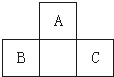 A、B、C均为短周期元素,它们在周期表中的位置如图.已知B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C所在的一组元素是( )
A、B、C均为短周期元素,它们在周期表中的位置如图.已知B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C所在的一组元素是( )| A. | Be、Na、Al | B. | B、Mg、Si | C. | C、Al、P | D. | O、P、Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2O2(l)=O2(g)+2H2O (l)△H=-196 kJ•mol-1 | |
| B. | 2N2(g)+O2(g)=2N2O(g)△H=+163 kJ•mol-1 | |
| C. | 2Ag(s)+Cl2(g)=2AgCl(s)△H=-254 kJ•mol-1 | |
| D. | 2HgO(s)=2Hg(l)+O2 (g)△H=+182kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com