
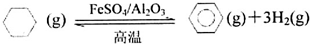
分析 Ⅰ①自发进行的判断依据是△H-T△S<0,结合反应特征分析判断需要的条件;
②平衡时是正逆反应速率相同,各组分含量保持不变,原则是变量不变分析选项;
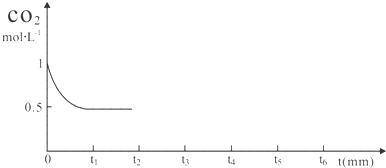
③图象t2起点,t3 到t4终点,t4以后符合变化趋势即可,在t2时将容器容积缩小一倍,压强增大,二氧化碳浓度增大,平衡正向进行,随后减小,t3时达到平衡,t4时降低温度,平衡正向进行,二氧化碳减小,反应速率减小,t5时达到平衡;
Ⅱ(1)已知:①Mg(s)+H2(g)═MgH2(s)△H1=-74.5kJ•mol-1
②Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H2=-64.4kJ•mol-1
由盖斯定律②-2×①得到Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s),据此计算;
(2)根据化学方程式Mg(AlH4)2═MgH2+2Al+3H2↑计算;
(3)根据LaNi5(s)+3H2(g)?LaNi5H6(s)△H<0,欲使LaNi5H6 (s)释放出气态氢,则平衡向逆向移动,据此分析;
(4)①依据平衡常数表达式解答;
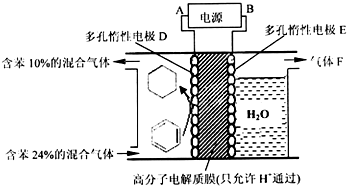
②该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷;
解答 解:Ⅰ.①)①CO2(g)+3H2(g)═CH3OH(l)+H2O(l),熵变△S<0,则反应焓变△H<0,低温下满足△H-T△S<0;
故答案为:低温;
②CO2(g)+3H2(g)═CH3OH(l)+H2O(l),
a、混合气体的平均式量始终保持不变,不能说明反应达到平衡状态,故a错误;
b、向2L密闭容器中加入2mol CO2、6mol H2,按照1:3反应,所以过程中CO2和H2的体积分数始终保持不变,故b错误;
c、向2L密闭容器中加入2mol CO2、6mol H2,按照1:3反应,CO2和H2的转化率始终相等,不能确定反应是否达到平衡状态,故c错误;
d、反应物是气体,生成物是液体,混合气体的密度保持不变,说明反应达到平衡状态,故d正确;
e、1mol CO2生成的同时有3mol H-H键断裂,说明正逆反应速率相同,反应达到平衡状态,故e正确;
故答案为:abc;
③在t2时将容器容积缩小一倍,压强增大,二氧化碳浓度增大,平衡正向进行,随后减小,t3时达到平衡,t4时降低温度,平衡正向进行,二氧化碳减小,反应速率减小,t5时达到平衡;
图象t2起点二氧化碳浓度突然增大为1mol/L,随反应进行减小,图中t3 到t4终点平衡线在0.5的线上,t4t4以后在0.5线以下,但不能到横坐标线上且有平衡线段,图象为: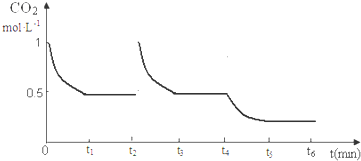 ;
;
故答案为: ;
;
Ⅱ.(1)已知:①Mg(s)+H2(g)═MgH2(s)△H1=-74.5kJ•mol-1
②Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H2=-64.4kJ•mol-1
由盖斯定律②-2×①得到Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3=+84.6KJ/mol;
故答案为:+84.6;
(2)储氢材料Mg(AlH4)2在110℃-200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑,从方程式可知反应中每转移6mol电子时生成3mol,所以反应中每转移3mol电子时产生的H2的物质的量为1.5,生成氢气33.6L;
故答案为:33.6;
(3)欲使LaNi5H6 (s)释放出气态氢,则平衡向逆向移动,由LaNi5(s)+3H2(g)?LaNi5H6(s)△H<0为气体减小的放热反应,所以可以升高温度或降低压强,平衡向逆向移动;
故答案为:bc;
(4)①环己烷的起始浓度为amol•L-1,平衡时苯的浓度为bmol•L-1,同一容器中各物质反应的物质的量浓度之比等于其计量数之比,所以根据方程式知,环己烷的平衡浓度为(a-b)mol/L,氢气的浓度为3bmol/L,则平衡常数K=$\frac{c(苯)•{c}^{3}({H}_{2})}{c(环己烷)}$=$\frac{27{b}^{4}}{a-b}$mol3•L-3;
故答案为:$\frac{27{b}^{4}}{a-b}$mol3•L-3;
②该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,电解池阴极与电源负极相连,得出电解过程中产生的气体F为O2,阴极上苯得电子和氢离子生成环己烷,电极反应式为C6H6+6H++6e-=C6H12;
故答案为:负;O2;C6H6+6H++6e-═C6H12.
点评 本题考查了反应自发进行的判断、盖斯定律的应用、平衡影响因素分析判断,平衡计算的分析应用及电解池原理等知识点,掌握基础是关键,综合性较强,题目难度较大,注意对相关知识的理解.


 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:选择题
| A. | 生活污水使用明矾杀菌消毒 | B. | 向燃煤中加入适量石灰石“固硫” | ||
| C. | 推广使用可降解塑料防止白色污染 | D. | 提倡公交出行可减少氮氧化物排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 性质 | 实际应用 |
| A | 活性炭可吸附水中的悬浮物 | 用于自来水的杀菌消毒 |
| B | SO2具有还原性 | 漂白纸浆 |
| C | 铁被氧气氧化时会放出热量 | 铁、活性炭、无机盐、水等的混合物制成暖宝贴 |
| D | 氧化铝是两性氧化物 | 作耐高温材料 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 世博会期间,利用可降解的“玉米翅料”替代一次性饭盒,可防止产生白色污染 | |
| B. | 世博停车场安装催化光解设施,可将汽车尾气中CO和NOx反应生成无毒气体 | |
| C. | 利用太阳能、风能和氢能等能源替代化石能源有利于实现“低碳经济” | |
| D. | 高纯度的硅单质广泛用于制作光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
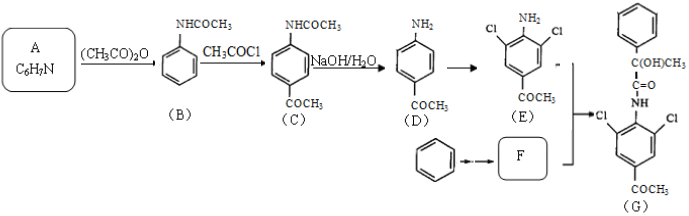 已知:
已知: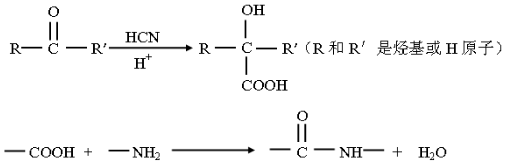
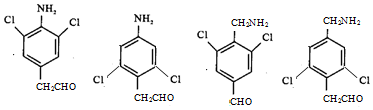
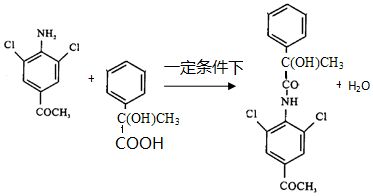
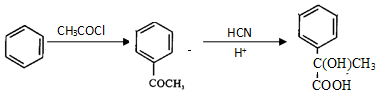 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
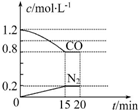 “霾”是当今世界环境热点话题.某地空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
“霾”是当今世界环境热点话题.某地空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
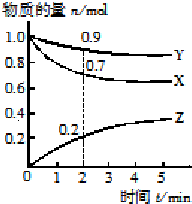 (1)向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按正反应速率由大到小顺序排列为乙甲丁丙.
(1)向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按正反应速率由大到小顺序排列为乙甲丁丙.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2CO3═2H++CO32- | B. | NaHSO4═Na++HSO4- | ||
| C. | NaHCO3?Na++HCO3- | D. | Ba(OH)2═Ba2++2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含有大量Fe3+的溶液中:Na+,SCN-,SO42-,NO3- | |
| B. | 在pH=1的溶液中:Fe3+,Mg2+,Cl-,SO42- | |
| C. | 在加入了FeSO4•7H2O晶体溶液中:Na+,H+,Cl-,NO3- | |
| D. | 能使紫色石蕊试液变红的溶液中:K+,HCO3-,NO3-,S2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com