
工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)  CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
某小组研究在相同温度下该反应过程中的能量变化。他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
(1)该反应过程中,反应物分子化学键断裂时所吸收的总能量 (填“大于”、“小于”或“等于”)生成物分子化学键形成时所释放的总能量。
(2)容器①中反应达平衡时,CO的转化率为 %。
(3)计算容器②中反应的平衡常数K= 。
(4)下列叙述正确的是 (填字母序号)。
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q > 65.6 kJ
c.反应开始时,两容器中反应的化学反应速率相等
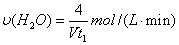 d.容器①中,化学反应速率为:
d.容器①中,化学反应速率为:
(5)已知:2H2 (g) + O2 (g) = 2H2O (g) ΔH=-484 kJ/mol,写出CO完全燃烧生成CO2的热化学方程式: 。
 (6)容器①中反应进行到t min时,测得混合气体中CO2的物质的量为0.6 mol。若用200 mL 5 mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示) 。
(6)容器①中反应进行到t min时,测得混合气体中CO2的物质的量为0.6 mol。若用200 mL 5 mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示) 。
(7)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用图中所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。
①写出阳极所发生反应的电极反应式: 。
②在制备金属钛前后,CaO的总量不变,其原因是(请结合反应式解释) 。
科目:高中化学 来源: 题型:
催化剂是化工技术的核心,绝大多数的化工生产均需采用催化工艺。
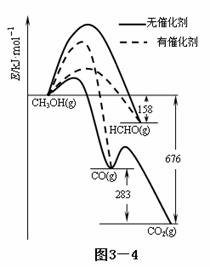
(1)人们常用催化剂来选择反应进行的方向。下图3—4所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。
①在有催化剂作用下,CH3OH与O2 反应主要生成 (填“CO、CO2、HCHO”);
②2HCHO(g)+O2(g)=2CO(g)+2H2O(g) △H= 。
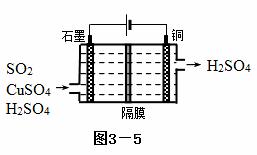
(2)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:
2SO2+2n Cu+(n+1)O2+(2-2 n) H2O=2n CuSO4+(2-2n) H2SO4
从环境保护的角度看,催化脱硫的意义为 ;每吸收标准状况下11.2L SO2,被SO2还原的O2的质量为 g。
②利用上图3—5所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作或对实验事实的叙述正确的是 ( )
①用稀盐酸洗涤盛放过石灰水的试剂瓶
②配制FeCl3溶液时,向溶液中加入少量Fe粉和稀盐酸
③用pH试纸测得氯水的pH为2
④用稀硝酸清洗做过银镜反应实验的试管
⑤浓硝酸保存在棕色细口瓶中
⑥将镁条和铝片用导线连接再插进稀NaOH溶液,铝条上产生气泡
⑦某溶液加入NaOH并加热能产生使湿润红色石蕊试纸变蓝的气体,则原溶液中含NH4+
⑧清洗试管内壁的MnO2用双氧水
A.①④⑤⑦ B.②③④⑦ C.①②⑥⑧ D.①⑤⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍。下列说法正确的是
A.X的氢化物溶于水显酸性 B.Y的氧化物是共价化合物
C.其离子半径大小: Z>Y>X D.X和Z的最高价氧化物对应的水化物都是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作与预期实验目的或结论均正确的是( )
| 选项 | 实验操作 | 预期实验目的或结论 |
| A | 室温下,用pH试纸测定浓度为0.1mol·L-1 Na2SiO3溶液和Na2CO3溶液的pH | 比较Si和C的电负性 |
| B | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中含有SO42- |
| C | 向某溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| D | 将某气体通入淀粉和KI的混合溶液,溶液变蓝色 | 该气体一定是Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
簸箩酯是一种食用香料,是化合物甲与苯氧乙酸 -O-CH2-COOH发生酯化反应的产物。
-O-CH2-COOH发生酯化反应的产物。
(1)甲一定含有的官能团的名称是_________。
(2)5.8g甲完全燃烧可产生0.3molCO2和0.3molH2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是______________________。
(3)苯氧乙酸有多种类型的同分异构体,其中能与FeCl3溶液发生显色反应,且有2种一硝基取代物的同分异构体是(写出任意2种的结构简式)___________ _____________。
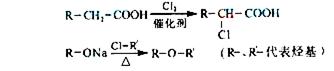 (4)已知:
(4)已知:
簸箩酯的合成线路如下:
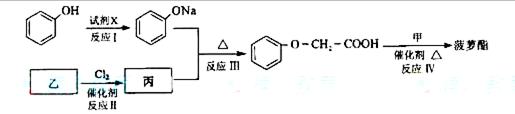
①试剂X不可选用的是(选填字母)__________。
a、CH3COONa溶液 b、NaOH溶液 c、NaHCO3溶液 d、Na
②丙的结构简式是___________,反应Ⅱ的反应类型是_____________________。
③反应Ⅳ的化学方程式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )

A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0
D.25 ℃时,该反应的平衡常数K=2.2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学用语的表示正确的是( )
A.过氧化钠的电子式: B.质子数为35、中子数为45的溴原子:Br
B.质子数为35、中子数为45的溴原子:Br
C.硫离子的结构示意图:
 D.HClO的结构式:H—Cl—O
D.HClO的结构式:H—Cl—O
查看答案和解析>>
科目:高中化学 来源: 题型:
由两种烃组成的混合气体2L与足量的氧气充分反应后生成CO2 5L、H2O 7L(所有体积都在120℃测定),则这两种混合气体的可能组成是( )
A.C2H4、C3H8 B.CH4、C5H8
C.CH4、C4H8  D.C2H6、C3H8
D.C2H6、C3H8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com