
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径 | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或 最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
| A.元素④的原子序数小于元素⑦的原子序数 |
| B.②、③处于同一周期 |
C.⑧号元素原子结构示意图为: |
| D.上述八种元素最高价氧化物对应的水化物,⑤号酸性最强 |
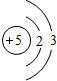 ,故C错误;
,故C错误;

科目:高中化学 来源:不详 题型:实验题
| A.联氨(N2H4)结构与C2H4相似,存在N=N双键 | |
| B.一分子联氨中含有的电子对数目为5 | C.联氨中的N原子的杂化类型为sp3杂化 |
| D.联氨能与HCl发生化合反应生成N2H6Cl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 元素性质 | 元素编号 | |||||
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 氢化物的沸点(℃) | -60.7 | -33.4 | 100 | -87.7 | 19.54 | -84.9 |
| 最高化合价 | +6 | +5 | +5 | +7 | ||
| 最低化合价 | -2 | -3 | -2 | -3 | -1 | -1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 周期族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A.氢化物稳定性:Z>W |
| B.原子半径的大小顺序:rX>rY>rQ>rW |
| C.元素Q和Z能形成QZ2型的共价化合物 |
| D.X、Y的最高价氧化物的水化物之间不能发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com