
| A. | 溶液中溶质的物质的量相等 | B. | 溶液中的c(H+)相等 | ||
| C. | 与足量锌粉反应产生的H2量相等 | D. | 可以电离出来的n(H+)相等 |
分析 相同温度下,pH和体积均相同盐酸和醋酸两种溶液,盐酸溶液中HCl完全电离,醋酸溶液中存在电离平衡,醋酸溶质浓度大于盐酸溶液浓度,
A.醋酸溶液中存在电离平衡,醋酸溶质浓度大于盐酸溶液浓度;
B.相同温度下,pH和体积均相同盐酸和醋酸两种溶液中氢离子浓度相同;
C.盐酸溶液中HCl完全电离,醋酸溶液中存在电离平衡,与足量锌粉反应,随反应进行醋酸电离平衡正向进行又发生电离;
D.相同温度下,pH和体积均相同盐酸和醋酸两种溶液,盐酸溶液中HCl完全电离,醋酸溶液中存在电离平衡,醋酸溶质浓度大于盐酸,能电离出的氢离子物质的量,醋酸溶液中多;
解答 解:相同温度下,pH和体积均相同盐酸和醋酸两种溶液,盐酸溶液中HCl完全电离,醋酸溶液中存在电离平衡,醋酸溶质浓度大于盐酸溶液浓度,
A.醋酸溶液中存在电离平衡,醋酸溶质浓度大于盐酸溶液浓度,溶液中溶质的物质的量醋酸中多,故A错误;
B.相同温度下,pH和体积均相同盐酸和醋酸两种溶液中氢离子浓度相同,故B正确;
C.盐酸溶液中HCl完全电离,醋酸溶液中存在电离平衡,与足量锌粉反应,随反应进行醋酸电离平衡正向进行,醋酸溶液中产生的H2量多,故C错误;
D.相同温度下,pH和体积均相同盐酸和醋酸两种溶液,盐酸溶液中HCl完全电离,醋酸溶液中存在电离平衡,醋酸溶质浓度大于盐酸,能电离出的氢离子物质的量,醋酸溶液中多,故D错误;
故选B.
点评 本题考查了弱电解质的电离,弱电解质电离受温度、浓度影响,弱电解质存在电离平衡,题目难度中等.


 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:解答题
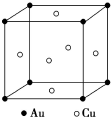 金和铜可以形成多种金属化合物,其中一种晶体的结构如图所示(为面心立方体结构).
金和铜可以形成多种金属化合物,其中一种晶体的结构如图所示(为面心立方体结构).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质溶液的导电性强弱是由浓度决定的 | |
| B. | 弱电解质和强电解质的导电,都是由带电离子的定向移动引起的 | |
| C. | 强电解质溶液导电能力强,弱电解质溶液导电能力弱 | |
| D. | 导电性强的溶液中的自由移动离子数目一定比导电性弱的溶液中的自由移动离子数目多 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 向100mL 3mol•L-1的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7.
向100mL 3mol•L-1的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 17gNH3中含有的质子数为10NA | |
| B. | 标准状况下,22.4LCl2与56gFe反应生成FeCl2分子的数目为NA | |
| C. | 7.0g丁烯含有C-H键的数目为NA | |
| D. | 常温下,1.0LpH=1的H2SO4溶液中,由水电离出的0H-的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
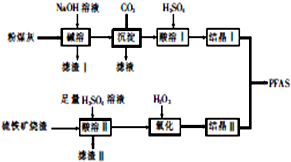 聚合硫酸铝铁[AlaFeb(OH)m(SO4)n•xH2O,简称PFAS]是一种新型高效水处理剂,以硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)和粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为主要原料制备PFAS的工艺流程如下:
聚合硫酸铝铁[AlaFeb(OH)m(SO4)n•xH2O,简称PFAS]是一种新型高效水处理剂,以硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)和粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为主要原料制备PFAS的工艺流程如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com