
【题目】已知:A是石油裂解气的主要产物之一,其产量是衡量一个国家石油化工发展水平的标志。下列是有机物A~G之间的转化关系:
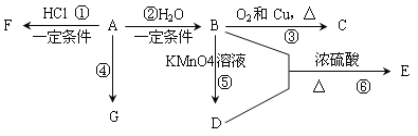
请回答下列问题:
(1)A、D中所含官能团的名称分别是_______________;C的结构简式是_____________;
(2)E是一种具有香味的液体,由B + D→E的反应方程式为:______________,反应类型是________。
(3)G是一种高分子化合物,其结构简式是____________________________________;
(4)俄罗斯足球世界杯激战正酣,在比赛中当运动员肌肉扭伤时,队医立即对其受伤部位喷射物质F进行应急处理。写出由A制F的化学反应方程式:___________。
(5)H是E的同分异构体,且H能与NaHCO3反应,则H的结构简式可能为(写出2种):_____________________________________________________________________。
【答案】 碳碳双键 羧基 CH3CHO CH3COOH + CH3CH2OH![]() CH3COOCH2CH3 + H2O 取代反应或酯化反应
CH3COOCH2CH3 + H2O 取代反应或酯化反应 ![]() CH2=CH2 + HCl
CH2=CH2 + HCl ![]() CH3CH2Cl CH3 CH2 CH2COOH 、(CH3)2 CHCOOH
CH3CH2Cl CH3 CH2 CH2COOH 、(CH3)2 CHCOOH
【解析】A是石油裂解气的主要产物之一,其产量是衡量一个国家石油化工发展水平的标志,说明A为乙烯,则根据转化关系分析,B为乙醇,C为乙醛,D为乙酸,E为乙酸乙酯,F为氯乙烷,G为聚乙烯。(1)根据以上分析可知,乙烯的官能团为碳碳双键,D的官能团为羧基;C为乙醛,结构简式为:CH3CHO;(2)E是乙酸乙酯,乙酸和乙醇在浓硫酸加热的条件下生成的,方程式为:CH3COOH + CH3CH2OH![]() CH3COOCH2CH3 + H2O,该反应类型为取代反应或酯化反应;(3)G为聚乙烯,结构简式为:
CH3COOCH2CH3 + H2O,该反应类型为取代反应或酯化反应;(3)G为聚乙烯,结构简式为: ![]() ; (4) 乙烯和氯化氢反应生成氯乙烷,方程式为:CH2=CH2 + HCl
; (4) 乙烯和氯化氢反应生成氯乙烷,方程式为:CH2=CH2 + HCl ![]() CH3CH2Cl; (5)H是E乙酸乙酯的同分异构体,能与碳酸氢钠反应,说明其含有羧基,所以可能的结构简式为:CH3CH2CH2COOH、(CH3)2 CHCOOH。
CH3CH2Cl; (5)H是E乙酸乙酯的同分异构体,能与碳酸氢钠反应,说明其含有羧基,所以可能的结构简式为:CH3CH2CH2COOH、(CH3)2 CHCOOH。


科目:高中化学 来源: 题型:
【题目】Na及其化合物是生活、生产实践中的重要物质.请回答下列有关问题.
(1)钠跟水剧烈反应,生成和 , 此实验说明钠的化学性质活泼.
(2)钠有两种氧化物,其中用于呼吸面具和潜水艇中作为氧气来源的氧化物是 , 该物质中氧元素的化合价为 .
(3)固体碳酸钠中含有碳酸氢钠杂质,除去此杂质的简单方法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学键的下列叙述中,正确的是( )
A.离子化合物可能含共价键
B.共价化合物可能含离子键
C.离子化合物中只含离子键
D.共价化合物中可能含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质发生化学变化时:①电子总数②原子总数③分子总数④物质的种类⑤物质的总质量 ⑥物质的总能量,反应前后肯定不发生变化的是
A.①②⑥B.①②⑤C.②⑤⑥D.①⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对大气污染物NOx进行研究具有重要环保意义。
(1)已知汽车汽缸中生成NO的反应为:N2(g)+O2(g)![]() 2NO(g)-Q。若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在10.0 L密闭汽缸内经过5s反应达到平衡,测得NO为0.02mol/L。请回答下列问题:5s内该反应的平均速率ν(N2)=_____________。 汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是:______________________________。
2NO(g)-Q。若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在10.0 L密闭汽缸内经过5s反应达到平衡,测得NO为0.02mol/L。请回答下列问题:5s内该反应的平均速率ν(N2)=_____________。 汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是:______________________________。
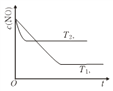
(2)右图表示在其他条件不变时,反应2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) 中,NO的浓度c(NO)在不同温度(T)下随时间(t)的变化曲线。该平衡的正向反应为_________反应 (填“吸热”或“放热”)。
2CO2(g)+N2(g) 中,NO的浓度c(NO)在不同温度(T)下随时间(t)的变化曲线。该平衡的正向反应为_________反应 (填“吸热”或“放热”)。
(3)为了减少汽车尾气对环境的污染,可采取的措施________________________(任写一个)。
另一方面,氮的许多化合物为我们人类生活带来便利。
(4)氨水是一种很好的氮肥,常温下测定0.1mol/L氨水溶液,其pH值小于13,其原因是_____(用电离方程式解释);常见氮肥种类有______________(列举两个)。
(5)硝酸铵易溶于水,其水溶液呈 ________(填“酸性”、“碱性”、或“中性”),原因是____________ (用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32- 等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示,下列说法正确的是
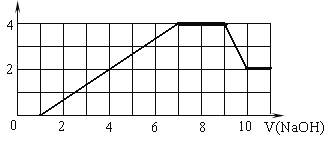
A. 原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+
B. 原溶液中一定含有SO42— 和Na+
C. 原溶液中含有的Fe3+和Al3+的物质的量之比为1∶1
D. 反应最后形成的溶液中含有的溶质为Na2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com