
| A. | ①③④ | B. | ②③⑤ | C. | ①②④⑤ | D. | ①②③④⑤ |
分析 ①氯元素检验需要在酸性条件下进行;
②用乙醇和浓硫酸共热到170℃制取乙烯;
③苯酚和溴发生取代反应;
④将苯与浓硝酸、浓硫酸混合加热至60℃制备硝基苯;
⑤用银氨溶液检验葡萄糖.
解答 解:①氯元素检验需要在酸性条件下进行,否则氢氧化钠和硝酸银反应生成沉淀而干扰实验,故错误;
②用乙醇和浓硫酸共热到170℃制取乙烯,该实验需要浓硫酸作催化剂,故错误;
③苯酚和溴发生取代反应生成白色沉淀,则在少量苯酚稀溶液中滴入过量饱和溴水出现白色沉淀,故错误;
④将苯与浓硝酸、浓硫酸混合加热至60℃制备硝基苯,该实验需要浓硫酸作催化剂,故错误;
⑤用银氨溶液检验葡萄糖,如果检验淀粉是否完全水解需要碘水,故错误;
故选D.
点评 本题考查化学实验方案评价,涉及物质或元素检验、物质的制备等知识点,会从实验的可行性及评价性进行分析判断,注意:有机反应较缓慢,大多数都需要催化剂,注意苯酚和溴发生取代反应需要浓溴水,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 用铝热反应焊接铁轨 | |
| B. | 镁条在二氧化碳中燃烧 | |
| C. | 用铝和氢氧化钠溶液反应制取氢气 | |
| D. | 用铜和氯化铁溶液反应,制作印刷电路板 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,下列说法中正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,下列说法中正确的是( )| A. | 从反应开始到第一次平衡时,N2的平均反应速率为0.005 mol•L-1•min-1 | |
| B. | 平衡在10 min至20 min的变化,可能是因为增大了容器体积 | |
| C. | 25 min时,分离出了0.1 mol NH3 | |
| D. | 在25 min后平衡向正反应方向移动,新平衡中NH3的体积分数比原平衡的小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
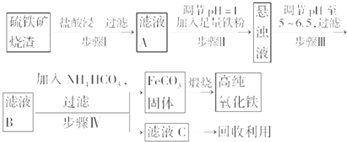
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3•2SO3•7H2O | B. | 4Fe2O3•10SO3•25H2O | ||
| C. | 3Fe2O3•6SO3•20H2O | D. | 2Fe2O3•5SO3•17H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3的热稳定性比NaHCO3强 | |
| B. | 相同温度时,Na2CO3 的溶解度大于NaHCO3 的溶解度 | |
| C. | Na2CO3 和NaHCO3都能和稀盐酸反应产生CO2 气体 | |
| D. | NaHCO3 一定条件下可转化为Na2CO3,但Na2CO3 不能转化为NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com