
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| N(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
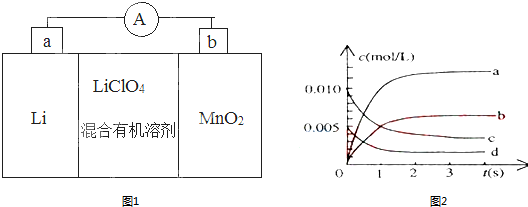
分析 (1)形成原电池反应时,Li为负极,被氧化,电极方程式为Li-e-=Li+,MnO2为正极,被还原,电极方程式为MnO2+e-+Li+=LiMnO2,结合电极方程式以及元素化合价的变化解答该题;
(1)①根据表格知,随着反应的进行,一氧化氮的物质的量减小,则平衡向正反应方向移动,二氧化氮的物质的量逐渐增大,根据一氧化氮和二氧化氮之间转化关系式计算平衡时二氧化氮的物质的量,从而确定曲线;
先计算一氧化氮的反应速率,再根据同一化学反应中同一时间段内,各物质的反应速率之比等于其计量数之比计算氧气的反应速率;
②增大反应速率需增大反应物的浓度、升高温度、使用催化剂等,增大反应物的浓度等可以使平衡向正反应方向移动.
解答 解:(1)①原电池工作时,Li为负极,MnO2为正极,电流从正极流向负极,所以外电路的电流方向是由b极流向a极,故答案为:b、a;
②MnO2为正极,被还原,电极方程式为MnO2+e-+Li+=LiMnO2,
故答案为:MnO2+e-+Li+=LiMnO2;
③因负极材料为Li,可与水反应,则不能用水代替电池中的混合有机溶剂,
故答案为:否;电极Li是活泼金属,能与水反应;
(2)①根据表格知,随着反应的进行,一氧化氮的物质的量减小,则平衡向正反应方向移动,二氧化氮的物质的量逐渐增大,当反应达到平衡状态时,参加反应的n(NO)=(0.020-0.007)mol=0.013mol,根据二氧化氮和一氧化氮的关系式知,平衡状态时生成n(NO2)等于参加反应的n(NO),所以为0.013mol,c(NO2)=$\frac{0.013mol}{2L}$=0.0065mol/L,所以代表二氧化氮的曲线为b;
0~2s时,v(NO)=$\frac{\frac{(0.020-0.008)mol}{2L}}{2s}$=0.003mol/(L.s),同一化学反应中同一时间段内,各物质的反应速率之比等于其计量数之比,所以v(O2)=$\frac{1}{2}$v(NO)=0.0015mol•L-1•S-1;
故答案为:b;0.0015mol•L-1•S-1;
②增大反应速率需增大反应物的浓度、升高温度、使用催化剂等,增大反应物的浓度等可以使平衡向正反应方向移动,所以为使该反应的反应速率增大,且平衡向正反应方向移动,需要增大氧气的浓度;
故答案为:c.
点评 本题考查电化学知识、反应速率的计算、化学平衡移动及其影响因素等,题目难度适中,能很好地考查学生的分析能力、计算能力以及电化学知识的综合理解和运用,题目难度中等.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:选择题
| A. | Al2O3→Al(OH)3 | B. | Na→Na2O2 | C. | Fe(OH)2→Fe(OH)3 | D. | Al(OH)3→AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲、乙、丙、丁 | B. | 丙、丁、乙、甲 | C. | 丙、丁、甲、乙 | D. | 丁、丙、乙、甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ②③ | C. | ③⑤ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度:T1>T2>T3 | B. | 平衡常数:K(a)>K(c) K(b)=K(d) | ||
| C. | 正反应速率:v(a)>v(c) v(b)>v(d) | D. | 平均摩尔质量:M(a)<M(c) M(b)>M(d) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X>Z>Y | B. | Z>Y>X | C. | X>Y>Z | D. | Z>X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中共消耗1.75 mol H2SO4 | B. | 气体甲中SO2与H2的体积比为1:4 | ||
| C. | 反应中共消耗65 g Zn | D. | 反应中共转移3.6 mol电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com