
镁电池毒性低、污染小,电压高而平稳,它逐渐成为人们研制绿色电池的关注焦点.其中一种镁电池的反应原理为:xMg+Mo3S4 Mg2Mo3S4,下列说法不正确的是( )
Mg2Mo3S4,下列说法不正确的是( )
|
| A. | 放电时,Mo3S4发生氧化反应 |
|
| B. | 放电时,正极反应式:Mo3S4+2xe﹣→Mo3S42x﹣ |
|
| C. | 充电时,Mg2+向阴极迁移 |
|
| D. | 充电时,阴极反应式:xMg2++2xe﹣→xMg |
| 化学电源新型电池.. | |
| 专题: | 电化学专题. |
| 分析: | 由总反应式可知,放电时,为原电池反应,Mg化合价升高,被氧化,电极反应式为xMg﹣2xe﹣═xMg2+,Mo3S4被还原,为原电池正极反应,电极反应式为Mo3S4+2xe﹣═Mo3S42x﹣,充电是电能转化为化学能的过程,阴极反应和原电池负极相反,发生还原反应. |
| 解答: | 解:A.放电时,Mo3S4被还原,为原电池正极反应,发生还原反应,电极反应式为Mo3S4+2xe﹣═Mo3S42x﹣,故A错误; B.放电时,Mo3S4发生还原反应,为原电池正极,正极反应式:Mo3S4+2xe﹣→Mo3S42x﹣,故B正确; C.充电时,Mg2+向阴极移动,在阴极被还原为Mg,故C正确; D.充电是电能转化为化学能的过程,阴极反应和原电池负极相反,发生还原反应,电极方程式为xMg2++2xe﹣═xMg,故D正确. 故选:A. |
| 点评: | 本题考查原电池与电解池知识,题目难度中等,注意根据电池总反应书写电极反应式,此为解答该题的关键,学习中注意体会书写方法. |


科目:高中化学 来源: 题型:
下列关于Na2CO3和NaHCO3的说法中不正确的是
A.可用澄清石灰水鉴别这两种物质
B.Na2CO3比NaHCO3更稳定
C.相同条件下0.5 mol/L Na2CO3溶液碱性比NaHCO3 强
D.等物质的量的Na2CO3和NaHCO3与足量盐酸反应生成的二氧化碳质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
已知同温同压下,下列反应的焓变和平衡常数分别表示为
H2(g)+ O2(g)=H2O(g)△H1 K1
O2(g)=H2O(g)△H1 K1
 N2(g)+O2(g)=NO2(g)△H2 K2
N2(g)+O2(g)=NO2(g)△H2 K2
 N2(g)+
N2(g)+ H2(g)=NH3(g)△H3 K3
H2(g)=NH3(g)△H3 K3
则反应2NH3(g)+ O2(g)=2NO2(g)+3H2O(g)的△H和K分别为( )
O2(g)=2NO2(g)+3H2O(g)的△H和K分别为( )
|
| A. | 2△H1+2△H2﹣2△H3 3K1+2K2﹣2K3 |
|
| B. | 2△H3﹣3△H1﹣2△H2 |
|
| C. | 3△H1+2△H2﹣2△H3 |
|
| D. | 3△H1+2△H2﹣2△H3 3K1+2K2﹣2K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在温度T℃下,某Ba(OH)2稀溶液中c(H+)=10﹣amol/L,c(OH﹣)=10﹣bmol/L,已知a+b=12,向该溶液中逐滴加入NaHSO4溶液,测得混合溶液的部分PH如下表所示:
| 序号 | 氢氧化钡的体积/mL | 硫酸氢钠的体积/mL | 溶液的PH |
| ① | 33.00 | 0.00 | 8 |
| ② | 33.00 | X | 7 |
| ③ | 33.00 | 33.00 | 6 |
(1)依据题意判断,T℃ 大于 25℃(填“大于”、“小于”或“等于”)
(2)b= 4 ,X= 27
(3)反应③的离子方程式为: Ba2++2OH﹣+2H++SO42﹣=BaSO4↓+2H2O
(4)将此温度下的Ba(OH)2溶液取出1mL,加水稀释至1L,则稀释后溶液中c(Ba2+):c(OH﹣) 1:20 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式书写正确的是( )
|
| A. | 2SO2+O2 |
|
| B. | C(s)+O2(g)═CO2(g)△H=+393.5 kJ/mol |
|
| C. | 500℃、30MPa下,将0.5mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) |
|
| D. | 2.00gC2H2气体完全燃烧生成液态水和二氧化碳气体,放出99.6kJ的热量,该反应的热化学方程式为:2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣2589.6kJ/moL |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定密闭容器中,反应aA(g)═bB(g)达平衡后,保持温度及各物质的量不变,将容器体积增加1倍,当达到新平衡时,B的浓度是原来的60%,则下列说法不正确的是( )
|
| A. | 平衡向正反应方向移动了 |
|
| B. | 物质A的转化率减少了 |
|
| C. | 容器体积增加可以是向其中充入了惰性气体 |
|
| D. | a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨工业对国民经济和社会发展具有重要的意义.根据已学知识回答下列问题:
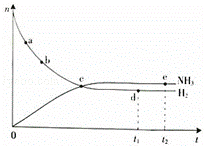
(1)对于密闭容器中的反应:N2(g)+3H2(g)═2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如右下图所示.
下列叙述正确的是 (填选项).
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大
(2)已知N2(g)+3H2 (g)═2NH3(g)△H=﹣92.4kJ•mol﹣1
①合成氨工业采取的下列措施不可用平衡移动原理解释的是 (填选项).
A.采用较高压强(20MPa~50MPa)
B.采用500℃的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来
②合成氨工业中采用了较高压强(20MPa~50MPa),而没有采用100MPa或者更大压强,试解释没有这么做的理由 .
③在容积均为2L(容器体积不可变)的甲、乙两个容器中,分别加入2molN2、6molH2和1molN2、3molH2,在相同温度、催化剂下使其反应.最终达到平衡后,两容器N2转化率分别为α甲、α乙,则甲容器中平衡常数表达式为 (用含α甲的代数式表示,化简为最简式),此时α甲 α乙(填“>”、“<”“=”).
查看答案和解析>>
科目:高中化学 来源: 题型:
以石化产品乙烯、丙烯为原料合成厌氧胶的流程如图:
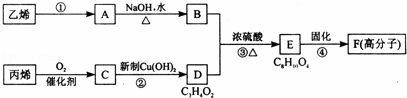
关于该过程的相关叙述正确的是( )
|
| A. | 反应④的反应类型是缩聚反应 |
|
| B. | 物质A是卤代烃 |
|
| C. | 物质B催化氧化后可以得到乙醛 |
|
| D. | 1 mol物质D最多可以消耗2 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
氢化阿托醛是一种重要的化工原料,其合成路线如下:
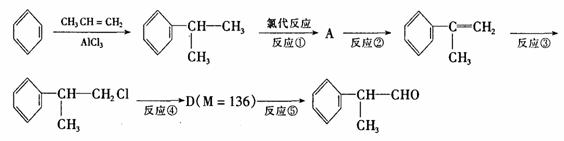
(1)氢化阿托醛被氧化后的含氧官能团的名称是 。
(2)在合成路线上②③的反应类型分别为② ③ 。
(3)反应④发生的条件是 。
(4)由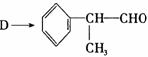 反应的化学方程式为 。
反应的化学方程式为 。
(5)1mol氢化阿托醛最多可和______mol氢气加成,1mol氢化阿托醛发生银镜反应可生成__________mol Ag。
(6)D与有机物X在一定条件下可生成一种相对分子质量为178的酯类物质,则X的结构简式为 。D有多种同分异构体,能满足苯环上有两个取代基,且能使FeCl3溶液显紫色的同分异构体有 种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com