
【题目】某无色混合溶液中可能含有的离子如下表所示:
可能大量含有的阳离子 | H+、Al3+、NH4+、Na+ |
可能大量含有的阴离子 | Cl-、AlO2-、SO42-、MnO4-、Br-、I-、CO32- |
为探究其成分,进行了以下探究实验。
探究一:
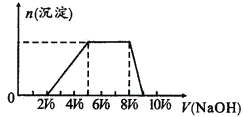
甲同学取一定量的混合溶液,用pH试纸检验,溶液pH<7;向其中逐液加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示。
探究二
乙同学取一定量的混合溶液,向溶液中加氯水,无气体产生,再加入CCl4振荡、静置,CCl4层呈橙红色,用分液漏斗分液;向分液后的水溶液中加入AgNO3和HNO3混合液,有白色沉淀产生。
探究三:
另取原溶液少量加入Ba(NO3)2和盐酸的混合液,产生白色沉淀。
(1)该溶液中一定含有的阴离子是___;其中能确定离子浓度之比的,对应离子物质的量浓度之比为___;不能肯定是否含有的离子是___。确定其中阳离子的实验方法为___。
(2)请写出沉淀减少过程中发生反应的离子方程式___。
【答案】Br- 、SO42- c(H+) :c(NH4+):c(Al3+)=2:3:1 Na+、Cl- 焰色反应 Al(OH)3+OH-═AlO2-+2H2O
【解析】
无色混合溶液中不能含有MnO4-;
由探究一知,溶液的pH<7,开始加入2V0NaOH无沉淀生成说明发生的反应是:H++OH-═H2O,有H+,则无AlO2-、CO32-;再加入氢氧化钠溶液至5V0,生成沉淀增多至最大,反应为Al3++3OH-═Al(OH)3↓,有Al3+,此过程消耗氢氧化钠溶液3V0;继续加入氢氧化钠,沉淀量不变,说明氢氧化钠和溶液中的铵根离子反应:NH4++OH-=NH3H2O,消耗氢氧化钠溶液3V0;继续加入氢氧化钠溶液,沉淀开始溶解,到加入9V0氢氧化钠溶液,沉淀全部溶解,发生的反应为Al(OH)3+OH-═AlO2-+2H2O,消耗氢氧化钠的体积V0;
根据探究二,向溶液中加氯水,无气体产生,说明无CO32-,再加入CCl4振荡、静置,CCl4层呈橙红色,说明有Br-,不含I-;用分液漏斗分液,向分液后的水溶液中加入AgNO3和HNO3混合液,有白色沉淀产生,说明分液后的水溶液中有Cl-,因为加入的氯水被还原成Cl-,不能确定原混合液中是否含Cl-;
根据探究三,加入少量Ba(NO3)2和盐酸的混合液,产生白色沉淀,说明原混合液中有SO42-;
综上分析,混合溶液中一定含有的离子:H+、Al3+、NH4+、Br-、SO42-,一定不含的离子:MnO4-、CO32-、I-、AlO2-,可能含有的离子:Na+、Cl-。
无色混合溶液中不能含有MnO4-;
由探究一知,溶液的pH<7,开始加入2V0NaOH无沉淀生成说明发生的反应是:H++OH-═H2O,有H+,则无AlO2-、CO32-;再加入氢氧化钠溶液至5V0,生成沉淀增多至最大,反应为Al3++3OH-═Al(OH)3↓,有Al3+,此过程消耗氢氧化钠溶液3V0;继续加入氢氧化钠,沉淀量不变,说明氢氧化钠和溶液中的铵根离子反应:NH4++OH-=NH3H2O,消耗氢氧化钠溶液3V0;继续加入氢氧化钠溶液,沉淀开始溶解,到加入9V0氢氧化钠溶液,沉淀全部溶解,发生的反应为Al(OH)3+OH-═AlO2-+2H2O,消耗氢氧化钠的体积V0;
根据探究二,向溶液中加氯水,无气体产生,说明无CO32-,再加入CCl4振荡、静置,CCl4层呈橙红色,说明有Br-,不含I-;用分液漏斗分液,向分液后的水溶液中加入AgNO3和HNO3混合液,有白色沉淀产生,说明分液后的水溶液中有Cl-,因为加入的氯水被还原成Cl-,不能确定原混合液中是否含Cl-;
根据探究三,加入少量Ba(NO3)2和盐酸的混合液,产生白色沉淀,说明原混合液中有SO42-;
(1)该溶液中一定含有的阴离子:Br-、SO42-;其中能确定离子浓度之比的是H+、NH4+、Al3+,根据它们消耗的NaOH溶液的体积和相应的离子方程式,c(H+):c(NH4+):c(Al3+)=2V0:3 V0:V0=2:3:1;不能肯定是否含有的离子:Na+、Cl-;确定是否含Na+的实验方法为:焰色反应;
(2)沉淀减少过程为Al(OH)3与NaOH的反应,反应的离子方程式:Al(OH)3+OH-═AlO2-+2H2O。


科目:高中化学 来源: 题型:
【题目】富镍三元层状氧化物LiNi0.8Co0.1Mn0.1O2(NCM811)作为下一代锂离子电池的正极材被广泛关注和深入研究,纳米级TiO2形成的表面包覆对提高该材料的性能效果明显。回答下列问题:
(1)Li在元素周期表中的位置为___;基态Ni的电子排布式为___,基态Co3+有__个未成对电子。
(2)制备NCM811的过程中,残余的Li2CO3会破坏材料的界面,CO32-的空间构型是___,其中C原子的杂化方式为___。
(3)该电池初始充电过程中,会有C2H4等气体产生。C2H4分子中。![]() 键和
键和![]() 键数目之比为__。
键数目之比为__。
(4)TiO2的晶胞(![]() =
=![]() =
=![]() =90o)如图所示:
=90o)如图所示:
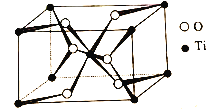
TiO2晶体中O原子的配位数是__,其晶胞参数为:a=b=459pm,c=295pm,该晶体的密度为__g/cm3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
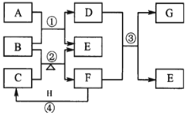
【题目】下图表示由元素周期表中1到20号且不同主族的元素组成的单质及化合物之间的转化关系(产物中的水已略去)。其中A为黄绿色气体单质,D有漂白性;在实验室中常用固体B和固体C加热制取刺激性气味F;F和G的组成元素相同,G与H分子所含电子数相同。
请回答
(1)单质A的组成元素在周期表中的位置是________;
(2)B的化学式为________,F的电子式为________,C中所含化学键类型有_______;
(3)写出反应②的化学方程式_____________;
(4)反应④中F和气体H在空气中相遇时的实验现象为__________写出的F一种具体用途_______________;
(5)向具有漂白作用的D溶液中加入H的浓溶液有A生成,其反应的离子方程式为______________。
(6)砷元素(As)与上述某元素处于同一主族。砷酸铅可用作杀虫剂。已知:
①在砷酸铅中,砷处于最高价态,铅处于稳定价态。
②砷酸铅是正砷酸对应的盐,1mol正砷酸分子中含有8mol原子.
砷的最高价氧化物的化学式为___________砷酸铅的化学式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我校环保兴趣小组在处理污水样品时,需用质量分数为37%的浓盐酸(密度为1.19g/cm3)配制成250mL 0.1mol·L-1的盐酸溶液。
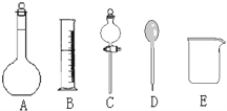
(1)在图所示仪器中,配制上述溶液不需要的是________(填序号);除图中已有仪器外,配制上述溶液还需要的玻璃仪器是________。
(2)根据计算,下列量程或规格中,本实验量筒应使用的是________;
A.10mL B.100mL C.250mL D.500mL
(3)在量取浓盐酸后,下列操作先后顺序是(用编号表示)________。
①待稀释的盐酸温度与室温一致后,沿玻璃棒注入所选定规格的容量瓶中。
②往容量瓶中小心加蒸馏水至液面接近环形刻度线1~2cm处,改用胶头滴管加蒸馏水,使凹液面最低处与瓶颈的环形刻度线相切。
③在盛盐酸的烧杯中注入适量蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
(4)在容量瓶的使用方法中,下列操作正确的是________。
A.使用容量瓶前不用检查它是否漏水
B.容量瓶用水洗净后,再用配好的稀HCl溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加水至接近刻度线处,1~2cm用胶头滴管加蒸馏水至刻度线
D.配制溶液时,若试样是液体,用量筒取试样后直接倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀
(5)若定容后摇匀静置,发现凹液面低于刻度线,此时应该________。
A.直接转移到细口试剂瓶中
B.再用胶头滴管加水,重新定容
C.将此溶液倒掉,重新配制
D.直接贮存于容量瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】南海是一个巨大的资源宝库,开发利用这些资源是科学研究的重要课题。如图为海水资源利用的部分过程,有关说法不正确的是( )
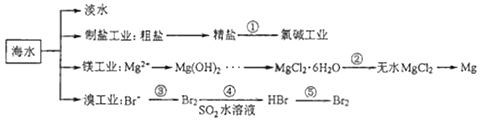
A.海水淡化的方法主要有蒸馏法、电渗析法
B.氯碱工业中采用阴离子交换膜可提高产品的纯度
C.由MgCl2·6H2O得到无水MgCl2要在HCl的气流中加热
D.溴工业中③、④的目的是为了富集溴元素,溴元素在反应③、⑤中均被氧化,在反应④中被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软质隐形眼镜材料W、树脂X的合成路线如图所示。
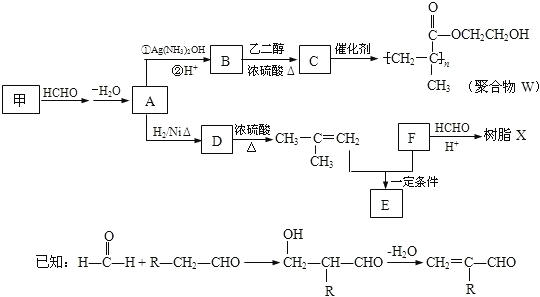
(1)A 中含有的官能团名称是_________。
(2)甲的结构简式是_____________。
(3)B→C反应的化学方程式是______________________________________________。
(4)B有多种同分异构体.属于酯且含有碳碳双键的同分异构体共有______种(不考虑顺反异构,下同),写出其中能发生银镜反应,且含有甲基的所有同分异构体的结构简式是___________。
(5)已知F的相对分子质量为110,分子中碳原子、氢原子数都是氧原子数的3倍,苯环上的氢原子化学环境都相同.则F还能发生的反应是________(填序号)。
A.加成反应 b.氧化反应 c.加聚反应 D.水解反应
(6)写出树脂X可能的结构简式___________(写出一种即可)。
(7)E的分子式为C10H14O2,含三个甲基,苯环上的一溴代物有两种,生成E的化学方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是 ( )
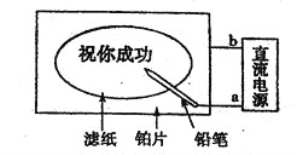
A.铅笔端作阳极,发生还原反应
B.铂片端作阴极,发生氧化反应
C.a点是负极,b点是正极
D.铅笔端有少量的氯气产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 与浓硝酸反应生成氮氧化物,这些氮氧化物溶解在
与浓硝酸反应生成氮氧化物,这些氮氧化物溶解在![]() 溶液中生成
溶液中生成![]() 和
和![]() 的混合溶液,反应过程及有关数据如图所示:
的混合溶液,反应过程及有关数据如图所示:
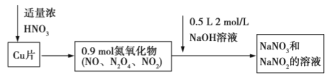
下列有关判断正确的是( )
A.若![]() 片为
片为![]() ,则生成
,则生成![]()
B.![]() 遇浓硝酸发生钝化,不可能发生上述反应
遇浓硝酸发生钝化,不可能发生上述反应
C.标准状况下收集的氮氧化物为![]()
D.![]() 既是氧化产物,也是还原产物
既是氧化产物,也是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一块铁的“氧化物”样品,用140mL 5.0mol·L-1盐酸恰好将之完全溶解,所得溶液还能吸收0.025mol Cl2,恰好使其中的Fe2+全部转变为Fe3+,则该样品可能的化学式为
A. Fe2O3B. Fe3O4C. Fe4O5D. Fe5O7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com