
| A. | x+y<z | B. | 平衡向正反应方向移动 | ||
| C. | B的转化率降低 | D. | C的产率不变 |
分析 平衡时测得A的浓度为0.80mol/L,保持温度不变,将容器的容积扩大到原来的两倍,如平衡不移动,则A的浓度应降低为0.4mol/L,而此时为0.4mol/L,则说明降低压强平衡向不发生移动,以此进行判断.
解答 解:平衡时测得A的浓度为0.80mol/L,保持温度不变,将容器的容积扩大到原来的两倍,如平衡不移动,则A的浓度应降低为0.4mol/L,而此时为0.4mol/L,则说明降低压强平衡向不发生移动,证明反应前后气体体积不变的反应,
A.减小压强平衡不变,x+y=z,故A错误;
B.保持温度不变,将容器的容积扩大到原来的两倍,如平衡不移动,则A的浓度应降低为0.4mol/L,而此时为0.4mol/L,则说明降低压强平衡向不发生移动,故B错误;
C.平衡不变,B的转化率不变,故C错误;
D.分析可知改变容器体积,压强减小,平衡不变,所以C的产率不变,故D正确;
故选D.
点评 本题考查化学平衡移动知识,题目难度不大,注意从浓度的变化的角度判断平衡移动的方向,结合压强对平衡移动的影响分析.


科目:高中化学 来源: 题型:选择题
| A. | 用湿润的有色布条 | B. | 用湿润的蓝色石蕊试纸 | ||
| C. | 将气体通入硝酸银溶液 | D. | 用湿润的淀粉碘化钾试纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
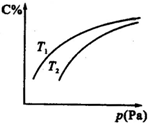
| A. | B一定为气体 | |
| B. | A一定为气体 | |
| C. | 若正反应方向△H<0,则T1>T2 | |
| D. | 压强增大时,混合气体的平均相对分子质量减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑧ | B. | ②④⑤⑦⑧ | C. | ④⑤⑧ | D. | ③④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+H+ AlO2- SO32- | B. | NH4+ Al3+SO42-Cl- | ||
| C. | OH- K+ SO42- HCO3- | D. | Fe2+Na+ ClO-NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠不能用于治疗胃溃疡病人的胃酸过多症 | |
| B. | 切开的金属Na暴露在空气中,光亮表面会逐渐变暗 | |
| C. | 发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔 | |
| D. | 金属镁在空气中燃烧的产物是纯净的氧化镁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com