
燃料电池是利用燃料(如CO、H2、CH4等)与氧气反应,将反应产生的化学能转变为电能的装置,通常用氢氧化钾作为电解质溶液。完成下列关于甲烷(CH4)燃料电池的填空:
(1)甲烷与氧气反应的化学方程式为:__________________。
(2)已知燃料电池的总反应式为CH4+2O2+2KOH===K2CO3+3H2O,电池中有一极的电极反应为CH4+10OH--8e-===CO+7H2O,这个电极是燃料电池的________(填“正极”或“负极”),另一个电极上的电极反应式为:___________________________。
(3)随着电池不断放电,电解质溶液的碱性________(填“增大”“减小”或“不变”)。
(4)通常情况下,甲烷燃料电池的能量利用率______(填“大于”“小于”或“等于”)甲烷燃烧的能量利用率。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )
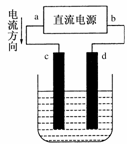
A.a为负极、b为正极
B.a为阳极、b为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
电池是人类生产和生活中的重要能量来源,各式各样电池的发明是化学对人类的一项重大贡献。下列有关电池的叙述正确的是( )
A.锌锰干电池工作一段时间后碳棒变细
B.氢氧燃料电池可将热能直接转变为电能
C.氢氧燃料电池工作时氢气在负极被氧化
D.太阳能电池的主要材料是高纯度的二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
已知空气—锌电池的电极反应为:锌片:Zn+2OH--2e-===ZnO+H2O;碳棒:O2+2H2O+4e-===4OH-,据此判断,锌片是( )
A.正极,被还原 B.正极,被氧化
C.负极,被还原 D.负极,被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2—NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)若ZnCl2—NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是________。欲除去Cu2+,最好选用下列试剂中的________(填选项字母)。
A.NaOH B.Zn
C.Fe D.NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下的密闭容器中,可逆反应A(g)+3B(g)2C(g)(g表示气态),在下列四种状态中处于平衡状态的是( )
| 速率 | A | B | C | D |
| v正/mol·(L·s)-1 | vA=1 | vB=2 | vA=1 | vC=1 |
| v逆/mol·(L·s)-1 | vB=1 | vC=2 | vC=2 | vC=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在2 L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图。反应在t时刻达到平衡,依图所示:

(1)该反应的化学方程式是___________________________。
(2)反应起始至t,Y的平均反应速率是_________________。
(3)X的转化率是_____________________________________。
(4)关于该反应的说法正确的是________。
A.到达t时刻反应已停止
B.在t时刻之前X的消耗速率大于它的生成速率
C.在t时刻正反应速率等于逆反应速率
D.在t时刻达到平衡是因为此时反应物总物质的量与生成物总物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭系统中有反应C(s)+CO2(g)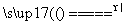 2CO(g),能使反应速度加快的措施是( )
2CO(g),能使反应速度加快的措施是( )
①通过减小容器体积增大压强 ②升高温度 ③将炭粉碎 ④通入CO2 ⑤增加炭的量 ⑥恒容条件下通入N2
A.①②③⑥ B.①②④⑥
C.①②③④ D.①②③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com