
 .
.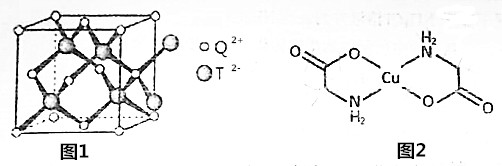
分析 E、G、M、Q、T是五种原子序数依次增大的前四周期元素,E、G、M是位于同一周期的元素,M的价层电子排布为nsnnp2n,s能级最多排列2个电子,则n=2,所以M价层电子排布式为2s22p4,为O元素;E与M原子核外的未成对电子数相等,则E是C元素,G为N元素;QO2与NO2-为等电子体,则Q为S元素;T为过渡元素,其原子核外没有未成对电子,则T为Zn元素.
(1)Zn元素位于第四周期IIB族;
(2)E、G、M的最简单氢化物分别CH4、NH3、H2O,根据孤对电子之间排斥力>孤对电子与成键电子对之间排斥力>成键电子对之间排斥力,可以判断键角大小;
(3)CO、N2互为等电子体,等电子体结构相似;
(4)晶体中一个T2-与周围的四个Q2+组成的空间构型为正四面体;
(5)分子中有2种C原子,杂化轨道数目分别为4、3;Cu与N、O之间形成配位键,属于σ键数,分子中共含有20个σ键.
解答 解:E、G、M、Q、T是五种原子序数依次增大的前四周期元素,E、G、M是位于同一周期的元素,M的价层电子排布为nsnnp2n,s能级最多排列2个电子,则n=2,所以M价层电子排布式为2s22p4,为O元素;E与M原子核外的未成对电子数相等,则E是C元素,G为N元素;QO2与NO2-为等电子体,则Q为S元素;T为过渡元素,其原子核外没有未成对电子,则T为Zn元素.
(1)Zn元素位于第四周期IIB族,价电子排布式是3d104s2,
故答案为:3d104s2;
(2)E、G、M的最简单氢化物分别CH4、NH3、H2O,甲烷中碳原子没有孤对电子,氨气中N原子有1对孤对电子,水分子中O原子有2对孤对电子,孤对电子之间排斥力>孤对电子与成键电子对之间排斥力>成键电子对之间排斥力,故键角大小顺序是CH4>NH3>H2O,
故答案为:CH4>NH3>H2O;
(3)CO、N2互为等电子体,等电子体结构相似,则CO分子结构式为 ,
,
故答案为: ;
;
(4)晶体中一个T2-与周围的四个Q2+组成的空间构型为正四面体,
故答案为:正四面体;
(5)分子中有2种C原子,杂化轨道数目分别为4、3,采取sp3、sp2杂化,N原子、O原子由孤对电子,Cu与N、O之间形成配位键,属于σ键数,分子中共含有20个σ键,1mol氨基乙酸铜分子中σ键数目为20NA,
故答案为:sp3、sp2;20NA;N、O.
点评 本题考查物质结构和性质,涉及核外电子排布、杂化方式、价层电子对互斥理论、等电子体、配合物、化学键、晶胞结构等,需要学生具备扎实的基础与灵活运用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 炭炉边放壶水,不能防止煤气中毒 | |
| B. | “水滴石穿”涉及学变化 | |
| C. | 颇受青眯的页岩气是非常规天然气,主要成分为CH4 | |
| D. | 油脂是高能量营养物质,肥胖者不能食用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
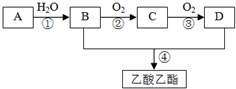 A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示. CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加工后具有吸水性的植物纤维可用作食品干燥剂 | |
| B. | 服用阿司匹林出现水杨酸反应时,用NaHCO3溶液解毒 | |
| C. | 明矾水解形成氢氧化铝胶体能杀菌消毒,可用水的净化 | |
| D. | 硫酸亚铁补铁剂应与维生素C同服,是因为维生素C可以防止Fe2+被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2$\stackrel{HCl}{→}$SiCl4$\stackrel{H_{2}}{→}$Si | |
| B. | MgCO3$\stackrel{HCl}{→}$MgCl2溶液$\stackrel{电解}{→}$Mg | |
| C. | Fe$→_{点燃}^{O_{2}}$Fe2O3$\stackrel{H_{2}SO_{4}}{→}$Fe2(SO4)3 | |
| D. | Na$→_{点燃}^{O_{2}}$Na2O2$\stackrel{CO_{2}}{→}$Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积(mL) | 标准KMnO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 3.00 | 23.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
| 难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸可以用于除去锅炉或水壶中的水垢 | |
| B. | 切开的苹果放置后变色和纸张久置后变黄的原理相同 | |
| C. | 蜂蚁蛰咬人时会向人体注入酸性物质,可涂抹小苏打溶液缓解疼痛 | |
| D. | 工业含酸废水可用氢氧化钡溶液处理后再排放,有利于减少水体污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com