

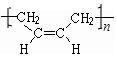
 .
.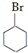 +NaOH$\stackrel{加热}{→}$
+NaOH$\stackrel{加热}{→}$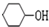 +NaBr.
+NaBr.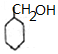 制备的合成路线.
制备的合成路线.分析 A可用于制备顺丁橡胶(顺式聚1,3-丁二烯),所以A为1,3-丁二烯,1,3-丁二烯与乙烯发生加成反应生成环己烯,环己烯与HBr发生加成反应生成C为 ,C发生水解反应生成D为
,C发生水解反应生成D为 ,环己醇发生氧化反应生成
,环己醇发生氧化反应生成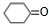 ,
, 与CH2=CH-CN发生加成反应生成E,比较菠萝酯和
与CH2=CH-CN发生加成反应生成E,比较菠萝酯和 的结构简式可知,
的结构简式可知, 与F为CH2=CHCH2OH发生酯化反应得到菠萝酯,以1,3-丁二烯为有机原料制备
与F为CH2=CHCH2OH发生酯化反应得到菠萝酯,以1,3-丁二烯为有机原料制备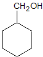 ,可以用两分子A发生加成反应生成
,可以用两分子A发生加成反应生成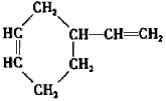 ,
, 发生信息②中反应生成
发生信息②中反应生成 ,
, 与氢气发生全加成反应生成
与氢气发生全加成反应生成 ,据此答题.
,据此答题.
解答 解:A可用于制备顺丁橡胶(顺式聚1,3-丁二烯),所以A为1,3-丁二烯,1,3-丁二烯与乙烯发生加成反应生成环己烯,环己烯与HBr发生加成反应生成C为 ,C发生水解反应生成D为
,C发生水解反应生成D为 ,环己醇发生氧化反应生成
,环己醇发生氧化反应生成 ,
, 与CH2=CH-CN发生加成反应生成E,比较菠萝酯和
与CH2=CH-CN发生加成反应生成E,比较菠萝酯和 的结构简式可知,
的结构简式可知, 与F为CH2=CHCH2OH发生酯化反应得到菠萝酯,
与F为CH2=CHCH2OH发生酯化反应得到菠萝酯,
(1)顺丁橡胶的链节为 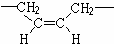 ,故顺丁橡胶的结构简式为
,故顺丁橡胶的结构简式为
故答案为: ;
;
(2)菠萝酯中含有的官能团为碳碳双键和酯基,根据上面的分析可知,F的结构简式为 CH2=CHCH2OH,反应④为环己醇发生氧化反应,反应的条件是催化剂、加热,
故答案为:碳碳双键和酯基;CH2=CHCH2OH;催化剂、加热;
(3)根据上面的分析可知,①一⑥反应中属于取代反应的是③⑥,
故答案为:③⑥;
(4)B为 ,
,
a.元素分析仪测定元素种类,不能进行定量分析,B的实验式为C3H5,故a错误;
b.B的相对分子质量为82,故B的最大质荷比的数值为82,故b正确;
c.红外光谱仪可测定原子团或官能团,不能测定空间构型,故c错误;
d.分子中含有3种化学环境不同的H原子,核磁共振仪可测定B有3种类型氢原子吸收峰,故d错误,
故答案为:b;
(5)反应③为 的碱性水解,反应的化学方程式为
的碱性水解,反应的化学方程式为 +NaOH$\stackrel{加热}{→}$
+NaOH$\stackrel{加热}{→}$ +NaBr,
+NaBr,
故答案为: +NaOH$\stackrel{加热}{→}$
+NaOH$\stackrel{加热}{→}$ +NaBr;
+NaBr;
(6)A为1,3-丁二烯,以1,3-丁二烯为有机原料制备 ,可以用两分子A发生加成反应生成
,可以用两分子A发生加成反应生成 ,
, 发生信息②中反应生成
发生信息②中反应生成 ,
, 与氢气发生全加成反应生成
与氢气发生全加成反应生成 ,反应的合成路线为CH2=CHCH=CH2$\stackrel{催化剂}{→}$
,反应的合成路线为CH2=CHCH=CH2$\stackrel{催化剂}{→}$


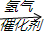
 ,
,
故答案为:CH2=CHCH=CH2$\stackrel{催化剂}{→}$


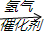
 .
.
点评 本题考查有机物的推断与合成,根据有机物的结构与反应条件进行分析,熟练掌握官能团的性质与衍变,(6)中有机合成路线的设计为本题难点,侧重对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 在Na2S溶液中加入AgCl固体,溶液中c(S2-)减小 | |
| C. | N2(g)+3H2(g)=2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大 | |
| D. | 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1HCl溶液与0.2 mol•L-1氨水等体积混合(pH>7):c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-) | |
| B. | Na2CO3溶液中:c(Na+)<2c(CO32-)+c(HCO3-) | |
| C. | c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c(NH4Cl)>c[(NH4)2SO4] | |
| D. | 0.1mol•L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3•H2O)+c(Fe2+)=0.3 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
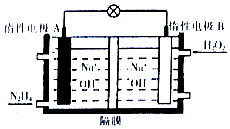 肼(N2H4)是一种高能燃料,在工业生产中用途广泛.
肼(N2H4)是一种高能燃料,在工业生产中用途广泛.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.| 离子半径 | 还原性 | 得电子能力 |
| N3-大于Al3+ | O2-小于S2- | 35Cl等于37Cl |
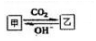
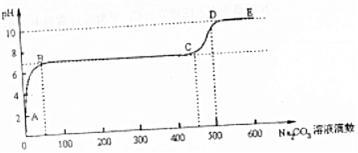
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度均为0.1mol•L-1的小苏打溶液与烧碱溶液等体积混合:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-) | |
| B. | pH相同的盐酸和硫酸,分别用蒸馏水稀释至原体积的m倍和n倍,稀释后两溶液pH相等,则m>n | |
| C. | 常温下,0.1mol•L-1某一元酸HA在水中有0.1%发生电离,则该温度下HA的电离常数约为10-7 | |
| D. | 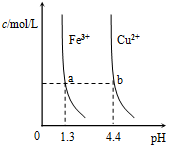 某温度下,Fe(OH)3,Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度的变化如图.由图可知:Ksp[Fe(OH)3]<K[Cu(OH)2] |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 NaCl
NaCl .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com