
【题目】I:已知:反应aA(g)+bB(g) ![]() cC(g),某温度下,在 2 L 的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在 2 L 的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
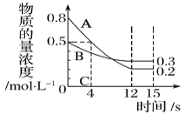
(1)经测定前4 s内v(C)=0.025 mol·L-1·s-1,则该反应的化学方程式为_______________。
(2)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 0mol·L-1·s-1; 乙:v(B)=0.10 mol·L-1·s-1; 丙:v(C)=2.4mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为_______(用甲、乙、丙表示)。
Ⅱ: 某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折合成标准状况),实验记录如表(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 | 6 |
氢气体积/mL | 50 | 120 | 224 | 392 | 472 | 502 |
(3)哪一时间段反应速率最大______(填0~1、1~2、2~3、3~4、4~5、5~6 min,下同),原因是_____________ 。
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是__________(填字母)
A.CH3COONa B.NaNO3溶液 C.KCl溶液 D.Na2CO3溶液
Ⅲ:(5)下列说法可以证明H2(g)+I2(g) ![]() 2HI(g)已达平衡状态的是________。
2HI(g)已达平衡状态的是________。
A.单位时间内生成n mol H2的同时,生成n mol HI
B.一个H—H键断裂的同时有两个H—I键断裂
C.温度和体积一定时,混合气体颜色不再变化
D.反应速率v(H2)=v(I2)=![]() v(HI)
v(HI)
【答案】6A(g)+2B(g) ![]() C(g) V(甲)= V(乙)> V(丙) 3-4分钟 因为该反应放热,温度升高,加快化学反应速率 AC B C
C(g) V(甲)= V(乙)> V(丙) 3-4分钟 因为该反应放热,温度升高,加快化学反应速率 AC B C
【解析】
I.(1)根据v= ![]() ,前4s内v(C)=0.05molL-1s-1,再由图像计算;
,前4s内v(C)=0.05molL-1s-1,再由图像计算;
(2)根据化学反应速率之比等于化学计量数之比,将不同物质的反应速率转化成相同物质的反应速率比较反应速率大小;
Ⅱ.(3)根据相同时间间隔内H2的体积变化判断化学速率大小;(4)减缓反应速率而又不减少产生氢气的量,考虑加入的物质不与已有反应物发生反应,同时又起到稀释作用;
Ⅲ.(5)化学反应达到化学平衡时,正逆反应速率相等,各组分浓度不改变,据此逐项分析判断。
I.(1)根据v= ![]() ,前4s内v(C)=0.025molL-1s-1,则C的浓度变化为△c(C)=v(C)△t=0.1mol/L,根据图像,相同时间段内,A与B的浓度变化之比为(0.8-0.2) ∶(0.5-0.3)=3∶1,0-4s内,A的浓度变化为△c(A)= (0.8-0.2)mol/L=0.6mol/L,所以A的浓度变化与C的浓度变化之比为0.6∶0.1=6∶1,所以a∶b∶c=6∶2∶1,所以化学方程式为:6A(g)+2B(g)
,前4s内v(C)=0.025molL-1s-1,则C的浓度变化为△c(C)=v(C)△t=0.1mol/L,根据图像,相同时间段内,A与B的浓度变化之比为(0.8-0.2) ∶(0.5-0.3)=3∶1,0-4s内,A的浓度变化为△c(A)= (0.8-0.2)mol/L=0.6mol/L,所以A的浓度变化与C的浓度变化之比为0.6∶0.1=6∶1,所以a∶b∶c=6∶2∶1,所以化学方程式为:6A(g)+2B(g)![]() C(g),故答案为:6A(g)+2B(g)
C(g),故答案为:6A(g)+2B(g)![]() C(g);
C(g);
(2)根据化学反应速率之比等于化学计量数之比,将不同物质的反应速率转化成相同物质的反应速率,不妨以A为参照,则v甲=v(A)=0.3mol/(Ls),v乙=v(A)=3v(B)=0.3mol/(Ls),v丙==v(A)=6v(C)= 6×2.4mol·L-1·min-1=0.24mol/(Ls),所以三个容器的反应速率大小为V(甲)= V(乙)> V(丙),故答案为:V(甲)= V(乙)> V(丙);
Ⅱ.(3)相同时间间隔内H2的体积变化越大,说明该时间段内反应速率越大,则反应速率最大的时间段为3~4min,原因是该反应是放热反应,此时温度高,温度对反应速率占主导作用,故答案为:3~4min;因为该反应放热,温度升高,加快化学反应速率;
(4)减缓反应速率而又不减少产生氢气的量,需要考虑加入的物质能减小溶液中氢离子的浓度,但又不影响最后生成氢气的总量。A.CH3COONa能够结合溶液中H+,但是随着反应进行,仍能电离,溶液中c(H+)降低,化学反应速率降低,但不影响H2的产生量,故可选;B.加入NaNO3溶液,NO3-在酸性条件下具有强氧化性,反应可产生氮氧化物,影响H2的产生量,故不选;C.加入KCl溶液,不参加反应,起稀释作用,降低反应速率,不影响H2产生量,故可选;D.Na2CO3溶液,消耗H+,放出二氧化碳气体,导致H2产生量降低,故不选,故答案为:AC;
Ⅲ.(5)A.单位时间内生成n molH2的同时,生成n molHI,表示的正逆反应速率不等,应生成2nmolHI才表示正逆反应速率相等,不能说明达平衡状态,故A错误;B.一个H-H键断裂的同时有两个H-I键断裂,说明v正=v逆,化学反应达到平衡,故B正确;C.温度和体积一定时,混合气体颜色不再变化,说明各反应物浓度不再改变,化学反应达到平衡,故C正确;D.反应速率v(H2)=v(I2)=![]() v(HI)始终成立,无法判断化学反应是否达到平衡,故D错误;故答案为:BC。
v(HI)始终成立,无法判断化学反应是否达到平衡,故D错误;故答案为:BC。


科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:x A(g) + yB(g) ![]() z C(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的2倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是( )
z C(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的2倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是( )
A. x+y>z B. 平衡向正反应方向移动 C. B的转化率升高 D. C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下Kw=10-13,在此温度下,将pH=a的NaOH溶液Va L与pH=b的H2SO4溶液Vb L混合,下列说法正确的是( )
A. 若所得混合液为中性,且a=12,b=2,则Va∶Vb=1∶1
B. 若所得混合液为中性,且a+b=12,则Va∶Vb=100∶1
C. 若所得混合液pH=10,且a=12,b=2,则Va∶Vb=1∶9
D. 若所得混合液pH=10,且a=12,b=2,则Va∶Vb=101∶99
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向 100mL1.5mol/L 的 NaOH 溶液中缓慢通入一定量的 CO2 ,充分反应后,向所得溶液中逐滴缓慢滴加稀盐酸,所得气体的体积与所加盐酸的体积(不考虑气体溶解于水)关系如图所示。
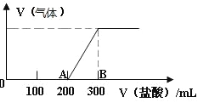
(1)通入一定量的 CO2 充分反应后的溶液中溶质为______(写化学式)
(2)AB 段所发生的离子方程式:______。
(3)滴加稀盐酸的物质的量浓度为______mol/L。
(4)通入二氧化碳的体积为____L(在标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蓄电池在放电时起原电池的作用,在充电时起电解池的作用。下面是爱迪生电池分别在充电和放电时发生的反应:Fe+NiO2+2H2O![]() Fe(OH)2+Ni(OH)2,下列有关爱迪生电池的推断不正确的是
Fe(OH)2+Ni(OH)2,下列有关爱迪生电池的推断不正确的是
A. 放电时,Fe是负极,NiO2是正极
B. 蓄电池的电极可以浸入某种酸性电解质溶液中
C. 充电时,阴极上的电极反应为:Fe(OH)2 + 2e-= Fe + 2OH-
D. 放电时,电解质溶液中的阴离子向负极方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不传热的固定容积的密闭容器中,可逆反应mA(g)+nB(g)![]() pC(g)+qD(g),当m、n、p、q为任意整数时,一定达到平衡的标志是( )
pC(g)+qD(g),当m、n、p、q为任意整数时,一定达到平衡的标志是( )
①体系的温度不再改变 ②体系的压强不再改变
③各组分的浓度不再改变 ④各组分的质量分数不再改变
⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q
⑥单位时间内m mol A发生断键反应,同时p mol C也发生断键反应
A. ③④⑤⑥B. ①③④⑥C. ②③④⑥D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中说明乙醇作为燃料的优点的是( )
①燃烧时发生氧化还原反应
②充分燃烧的产物不污染环境
③乙醇是一种可再生能源
④燃烧时放出大量热量
A.①②③B.①②④C.①③④D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2mol A与2 mol B混合于2 L的密闭容器中,发生如下反应:2A(g)+3B(g)![]() 2C(g)+zD(g)。若2s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是( )
2C(g)+zD(g)。若2s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是( )
A. v(C)=v(A)=0.2 mol·L-1·s-1
B. z=3
C. B的转化率为75%
D. 反应前与2 s后容器的压强比为4∶3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com