锰、铝、铁、钠的单质及其化合物在工业生产中有着广泛应用.请回答下列问题:
(1)工业上可用铝与软锰矿(主要成分为MnO
2)反应来冶炼锰.
①用铝与软锰矿冶炼锰的原理是(用化学方程式来表示)
.
②MnO
2在H
2O
2分解反应中作催化剂.若将适量MnO
2加入酸化的H
2O
2的溶液中,MnO
2溶解产生Mn
2+,该反应的离子方程式是
.
(2)将一定量的铁粉在氯气中燃烧后所得固体溶于水可得到溶液X.取少量X溶液两份,一份加入KSCN溶液时,溶液显红色;另一份中加入黄色铁氰化钾 (K
3[Fe(CN)
6])溶液后能发生复分解反应生成蓝色沉淀.已知:K
3[Fe(CN)
6]的电离方程式为K
3[Fe(CN)
6]=3K
++[Fe(CN)
6]
3-.请分析:
①用化学方程式表示产生两种金属阳离子的原因
.
②蓝色沉淀是由铁氰化钾与低价态阳离子反应的结果,试写出该反应的离子方程式
.
(3)将15.6g Na
2O
2和5.4g Al同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入HCl气体6.72L(标准状况),若忽略反应过程中溶液的体积变化.
请完成下列问题:
①反应过程中共得到的气体的体积为
(标准状况);
②最终是否有沉淀产生?
(填“是”或“否”),若有沉淀产生,其质量为
. (若不存在,则不必回答第(2)问)



 小学能力测试卷系列答案
小学能力测试卷系列答案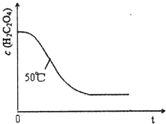 某小组利用H2C204溶液和酸性KMn04溶液反应来探究“条件对化学反应速率的影响”.
某小组利用H2C204溶液和酸性KMn04溶液反应来探究“条件对化学反应速率的影响”.