
| A. | 物质所含元素化合价升高的反应叫还原反应 | |
| B. | 能通过化合反应制得FeCl2和Fe(OH)3 | |
| C. | 某元素由化合态变为游离态,则它一定被还原 | |
| D. | 有单质参加的化学反应一定都是氧化还原反应 |
分析 A.化合价升高被氧化;
B.FeCl2与Fe反应生成FeCl3,Fe(OH)2与氧气、水化合生成Fe(OH)3;
C.由化合态变为游离态,元素的化合价可能升高,也可能降低;
D.有单质参加的反应不一定存在化合价的变化.
解答 解:A.物质所含元素化合价升高被氧化,属于氧化反应,故A错误;
B.FeCl2与Fe发生化合反应生成FeCl3,Fe(OH)2与氧气、水发生化合反应生成Fe(OH)3,故B正确;
C.由化合态变为游离态元素的化合价可能升高,也可能降低,可能被氧化,也可能被还原,故C错误;
D.有单质参加的反应不一定存在化合价的变化,如氧气转化为臭氧,故D错误;
故选B.
点评 本题考查氧化还原反应,侧重基本概念的考查,明确反应中氧化还原反应中氧化剂、还原剂与化合价的变化及反应的特征即可解答,题目难度不大.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:选择题
| A. | 根据分散质粒子能否透过滤纸,可以将分散系分为溶液、胶体和浊液 | |
| B. | 根据某物质中是否含有氢元素,判断该物质是否属于酸 | |
| C. | 根据化学反应前后,是否有电子转移,判断反应是否属于氧化还原反应 | |
| D. | 根据某物质中是否含有氧元素,可以判断该物质是否属于氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性氧化物一定是非金属氧化物,混合物、分散系、胶体有从属关系 | |
| B. | 元素的单质可由氧化或还原含该元素的化合物来制得 | |
| C. | 得电子越多的氧化剂,其氧化性就越强;含最高价元素的化合物一定具有强的氧化性 | |
| D. | 烧碱、熟石灰均属于碱,酸、碱、盐之间发生的反应均属于复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
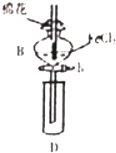 某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:| 过程Ⅱ中检出离子 | 过程ⅠV中检出离子 | |
| 甲 | 有 Fe3+无 Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有S042- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,所得溶液的pH<7 | |
| B. | 某物质的溶液中由水电离出的c(H+)=1×10-amol•L-1,若a>7,则该溶液的pH一定为14-a | |
| C. | 将0.2mol•L-1的某一元酸HA溶液和0.1mol•L-1 NaOH溶液等体积混合后,混合溶液的pH大于7,则反应后的混合溶液中:2c(OH-)=2c(H+)+c(HA)-c(A-) | |
| D. | pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合溶液的pH=7,则反应后的混合溶液中:2c(R2-)+c(HR-)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 点燃的镁条在二氧化碳中继续燃烧 | B. | Ca(OH)2与NH4Cl的反应 | ||
| C. | 灼热的碳与二氧化碳的反应 | D. | 酸碱中和反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “血液透析”利用了胶体的性质 | |
| B. | 华裔科学家高琨因在光纤传输信息领域中取得突破性成就而获得诺贝尔奖,光纤的主要成分是高纯度的二氧化硅 | |
| C. | 玻璃钢是一种合金,广泛用于汽车车身 | |
| D. | 只要符合限量,“亚硝酸盐”、“食用色素”、“苯甲酸钠”可以作为某些食品的添加剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com