

���� ��1����˹���ɵ�����Ϊ����ѧ��Ӧ�ķ�Ӧ��ֵ�뷴Ӧ��ʼ̬����̬�йأ����뷴Ӧ���е�;���أ����ݸ�˹���ɣ��õ�һ���Ȼ�ѧ����ʽ��ȥ�ڶ����Ȼ�ѧ����ʽ�ɵý�̿��ˮ������Ӧ���Ȼ�ѧ����ʽ��
��2������ͼ��֪��6minʱCl2��ƽ��Ũ��Ϊ0.3mol/L���仯Ϊ1.2mol/L-0.3mol/L=0.9mol/L������V=$\frac{��c}{��t}$���м��㣻
��Cl2��g��+CO��g��?COCl2��g������Ӧ�����������С�ķ�Ӧ����ѧ��Ӧ���淴Ӧ������ͬʱ��Ӧ�ﵽƽ��״̬������ֺ������ֲ����Լ������Ĺ�ϵ������
�۵�8min��Ӧ����ƽ��״̬���ڵ�10����ʱ�Ǹı��¶�ʹƽ�����淴Ӧ�����ƶ����ɢ�����ƽ�����淴Ӧ�����ƶ�����֪����ӦΪ���ȷ�Ӧ�������¶�ƽ�����淴Ӧ�����ƶ���
��ԭƽ��ʱn��Cl2����n��CO����n��COCl2��=3��1��9�����ڵ�7 min ������ϵ�е��������ʸ�2 mol����Ӧ���Ũ������̶ȴ�Щ��ƽ�������ƶ���
��� �⣺��1���ɢ�H2��g��+$\frac{1}{2}$O2��g���TH2O��g����H=-241.8kJ•mol-1��
��C��s��+$\frac{1}{2}$O2��g���TCO��g����H=-110.5kJ•mol-1��
���ø�˹���ɣ�����-�ٿɵã�C��s��+H2O��g��=CO��g��+H2��g������H=��-110.5kJ/mol��-��-241.8kJ/mol��=+13l.3 kJ/mol��
���Խ�̿��ˮ������Ӧ���Ȼ�ѧ����ʽΪ��C��s��+H2O��g���TCO��g��+H2��g����H=+13l.3kJ•mol-1��
�ʴ�Ϊ��C��s��+H2O��g��=CO��g��+H2��g����H=+131.3kJ•mol-1��
��2������ͼ��֪��6minʱCl2��ƽ��Ũ��Ϊ0.3mol/L���仯Ϊ1.2mol/L-0.3mol/L=0.9mol/L����V=$\frac{��c}{��t}$=$\frac{0.9mol/L}{6min}$=0.15 mol•L-1•min -1��
�ʴ�Ϊ��0.15 mol•L-1•min -1��
��Cl2��g��+CO��g��?COCl2��g������Ӧ�����������С�ķ�Ӧ��
A����ϵ��Cl2��ת���ʲ���˵����Ӧ�ﵽƽ��״̬����A��ȷ��
B����Ӧǰ���������ʵ�����С�������������䣬��ϵ�������ƽ��Ħ���������ٸı�˵����Ӧ�ﵽƽ��״̬����B��ȷ��
C��ÿ����1mol CO��ͬʱ����1mol COCl2��ֻ��˵����Ӧ������У�����˵����Ӧ�ﵽƽ��״̬����C����
D����������������������䣬��������ܶ�ʼ�ղ��䣬����˵����Ӧ�ﵽƽ��״̬����D����
�ʴ�Ϊ��AB��
�۸���ͼ��8min��Ӧ����ƽ��״̬���ڵ�10����ʱ�Ǹı��¶�ʹƽ�����淴Ӧ�����ƶ����ɢ�����ƽ�����淴Ӧ�����ƶ�����֪����ӦΪ���ȷ�Ӧ�������¶�ƽ�����淴Ӧ�����ƶ�����T��8����T��15����
�ʴ�Ϊ������
��8minʱ��ƽ��ʱc��Cl2��=0.3mol/L��c��CO��=0.1mol/L��c��COCl2��=0.9mol/L����ԭƽ��ʱn��Cl2����n��CO����n��COCl2��=3��1��9�����ڵ�7 min ������ϵ�е��������ʸ�2 mol����Ӧ���Ũ������̶ȴ�Щ��ƽ�������ƶ���
�ʴ�Ϊ�����ң�
���� ���⿼���Ϊ�ۺϣ��漰�ȷ�Ӧ����ʽ����ѧƽ����㡢��ѧƽ��Ӱ�����ء���ѧƽ�ⳣ������Ӧ���ʼ���ȣ�Ϊ�߿��������ͣ����ؿ���ѧ����ͼ�������ݵķ�����������������Ŀ�Ѷ��еȣ�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��һ���¶��£�4L�ܱ�������ijһ��Ӧ������M������N�����ʵ�����ʱ��仯��������ͼ��
��һ���¶��£�4L�ܱ�������ijһ��Ӧ������M������N�����ʵ�����ʱ��仯��������ͼ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| �������� | ��ʼ������pH | ������ȫ��pH | ���� | 20��ʱ�ܽ��ԣ�H2O�� | |
| Fe3+ | 1.1 | 3.2 | CaSO4 | �� | |
| Fe2+ | 5.8 | 8.8 | NiF | ���� | |
| Al3+ | 3.0 | 5.0 | CaF2 | ���� | |
| Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.6��10-4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Kspֻ�����ܵ���ʵ����ʺ��¶��йأ�������Һ�е�����Ũ���� | |
| B�� | ��֪ʱ25��ʱKsp[Fe��OH��3]=4.0��10-38������¶��·�ӦFe��OH��3+3H+?Fe3++3H2O��ƽ�ⳣ��K=4.0��104 | |
| C�� | ������Na2SO4��Һ���뵽����ʯ��ˮ�У��а�ɫ����������˵��Ksp[Ca��OH��2]����Ksp��CaSO4�� | |
| D�� | ��֪25��ʱ��Ksp[Mg��OH��2]=1.8��10-11����MgCl2��Һ�м��백ˮ�����Һ��pH=11���������������ʱ��Һ�е�c ��Mg2+��=1.8��10-5mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���

 ��
�� ��
��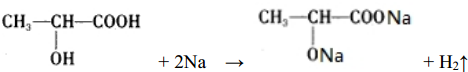 ��
�� ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������� | B�� | �Ȼ��� | C�� | �������� | D�� | �Ȼ��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com