
【题目】香豆素衍生物Q是合成抗肿瘤、抗凝血药的中间体,其合成路线如下。

已知:
I、
II、![]()
(1)A的分子式为C6H6O,能与饱和溴水反应生成白色沉淀。
① 按官能团分类,A的类别是_________。
② 生成白色沉淀的反应方程式是_________。
(2)A→B的反应方程式是_________。
(3)D→X的反应类型是_________。
(4)物质a的分子式为C5H10O3,核磁共振氢谱有两种吸收峰,由以下途径合成:

物质a的结构简式是_________。
(5)反应ⅰ为取代反应。Y只含一种官能团,Y的结构简式是_________。
(6)生成香豆素衍生物Q的“三步反应”,依次为“加成反应→消去反应→取代反应”,其中“取代反应”的化学方程式为_________。
(7)研究发现,一定条件下将香豆素衍生物Q水解、酯化生成 ![]() ,其水溶性增强,更有利于合成其他药物。请说明其水溶性增强的原因:______。
,其水溶性增强,更有利于合成其他药物。请说明其水溶性增强的原因:______。
【答案】酚类 ![]() +3Br2
+3Br2 +3HBr
+3HBr ![]() +HCHO
+HCHO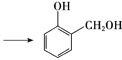 取代(酯化)反应
取代(酯化)反应 ![]()
![]()
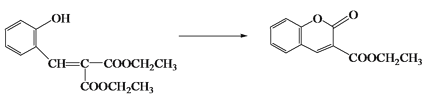 +CH3CH2OH –COOH是强亲水性基团
+CH3CH2OH –COOH是强亲水性基团
【解析】
A的分子式为C6H6O,能与饱和溴水反应生成白色沉淀,则A为苯酚,结合A与甲醛反应生成B,B发生氧化反应生成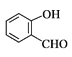 ,可知B为
,可知B为 ;煤多步转化为D,根据D的分子式并结合酯化反应的条件可知,D为乙醇,乙醇与乙酸发生酯化反应生成乙酸乙酯,则X为乙酸乙酯(CH3COOCH2CH3),根据已知信息II可知,乙酸乙酯与物质a发生取代反应生成了乙醇与物质Y,物质Y与
;煤多步转化为D,根据D的分子式并结合酯化反应的条件可知,D为乙醇,乙醇与乙酸发生酯化反应生成乙酸乙酯,则X为乙酸乙酯(CH3COOCH2CH3),根据已知信息II可知,乙酸乙酯与物质a发生取代反应生成了乙醇与物质Y,物质Y与 可合成目标产物
可合成目标产物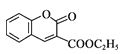 ,结合条件再分析作答。
,结合条件再分析作答。
(1)A的分子式为C6H6O,能与饱和溴水反应生成白色沉淀,则A为苯酚,
① 按官能团分类,A属于酚类,故答案为:酚类;
② 苯酚与浓溴水反应生成三溴苯酚白色沉淀,其反应方程式为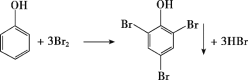 ,故答案为:
,故答案为: 。
。
(2)A→B的反应为苯酚与甲醛生成 的过程,其化学方程式为
的过程,其化学方程式为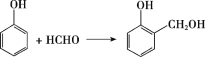 ,故答案为:
,故答案为: ;
;
(3)D→X为乙醇与乙酸在浓硫酸催化作用下加热生成乙酸乙酯的过程,其反应类型为取代(酯化)反应,故答案为:取代(酯化)反应;
(4)D为乙醇,与![]() 发生取代反应会生成
发生取代反应会生成![]() ,其分子式为C5H10O3,故答案为:
,其分子式为C5H10O3,故答案为:![]() ;
;
(5)根据给定已知信息II及上一问求出的物质a的结构简式可知,CH3COOCH2CH3与物质a发生取代反应生成Y与乙醇,且Y中只含一种官能团,则Y为![]() ,故答案为:
,故答案为:![]() ;
;
(6)物质Y为![]() ,与
,与 根据给定已知条件I先发生加成反应生成
根据给定已知条件I先发生加成反应生成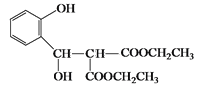 ,
, 在经过消去反应生成
在经过消去反应生成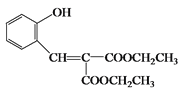 ,
, 再自身发生取代反应生成
再自身发生取代反应生成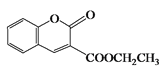 ,故答案为:
,故答案为: ;
;
(7) 与
与![]() 相比,从官能团结构可以看出,因为–COOH是强亲水性基团,所以引入的羧基导致其水溶性增强,故答案为:–COOH是强亲水性基团。
相比,从官能团结构可以看出,因为–COOH是强亲水性基团,所以引入的羧基导致其水溶性增强,故答案为:–COOH是强亲水性基团。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】分别按如图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中A为电流表。请回答下列问题:

(1)以下叙述中,正确的是________(填字母)
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH 均增大
D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
F.乙溶液中SO42-向铜片方向移动
(2)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是______。
(3)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式及总反应离子方程式:铜电极:______,总反应:______。 当电路中转移 0.25mol 电子时,消耗负极材料的质量为______g(Zn的相对原子质量为65)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某化学小组拟用该装置制取纯净的O2。

(1)若C是一种淡黄色固体,则烧瓶中发生反应的化学方程式是___。
(2)若C是一种黑色粉末,则B是_________,C的作用是________________。
(3)广口瓶中盛装的试剂D是___________,其作用是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2和H2在催化剂表面合成氨的微观历程及能量变化的示意图如图所示,用![]() 、、
、、![]() 分别表示N2、H2、NH3,下列说法正确的是( )
分别表示N2、H2、NH3,下列说法正确的是( )
![]()

A.使用催化剂时,合成氨的反应放出的热量减少
B.在该过程中,N2、H2 断键形成 N 原子和 H 原子
C.在该过程中,N原子和H原子形成了含有非极性键的NH3
D.合成氨反应中,反应物断键吸收的能量大于生成物形成新键释放的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向一容积为5 L的恒容密闭容器中充入0.4 mol SO2和0.2 mol O2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196 kJ/mol。当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
2SO3(g) ΔH=-196 kJ/mol。当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
(1 )判断该反应达到平衡状态的标志是___________(填字母)。
A.SO2、O2、SO3三者的浓度之比为2∶1∶2 B.容器内气体的压强不变
C.容器内混合气体的密度保持不变 D.SO3的物质的量不再变化
E.SO2的生成速率和SO3的生成速率相等
(2)①SO2的转化率=_______________;②达到平衡时反应放出的热量为____________kJ;③此温度下该反应的平衡常数K=__________。
(3)右图表示平衡时SO2的体积分数随压强和温度变化的曲线,则:

①温度关系:T1________T2(填“>”、“<”或“=”,下同);
②平衡常数关系:KA_________KB,KA_________KD。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
则下列说法正确的是
A.△H1<0,△H2>0
B.反应①②③的反应热满足关系:△H2-△H1=△H3
C.反应①②③的平衡常数满足关系:K1·K2=K3
D.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取升温措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿佛加德罗常数为NA,下列叙述正确的是
A.1molD2O所含质子数为12NA;B.1molNa2O2与足量水反应转移电子数为2NA;
C.10g 氖气所含原子数为0.5NA;D.标况下22.4L正戊烷含氢原子数为12NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2N0+O2在密闭容器中反应,达到平衡状态的标志是( )
2N0+O2在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成nmolO2的同时生成2nmolNO2
②单位时间内生成nmolO2的同时生成2nmolNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2 : 2 : l 的状态
④混合气体的颜色不再改变的状态
A. ①④ B. ②③ C. ①③④ D. ①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com