
| A. | 在该温度下平衡常数K=1 | |
| B. | 平衡时通入CO气体,则再次达平衡时,H2O的转化率增大.而CO的转化率减小 | |
| C. | 平衡时CO的体积分数为25% | |
| D. | 平衡常数与反应温度无关 |
分析 加入1molCO和1molH2O,达到平衡时测得n(H2)为0.5mol,则
CO(g)+H2O(g)?CO2(g)+H2(g)
开始 1 1 0 0
转化 0.5 0.5 0.5 0.5
平衡 0.5 0.5 0.5 0.5
A.K为生成物浓度幂之积与反应物浓度幂之积的比;
B.平衡时通入CO气体,平衡正向移动;
C.体积分数等于物质的量分数;
D.K为温度的函数.
解答 解:加入1molCO和1molH2O,达到平衡时测得n(H2)为0.5mol,则
CO(g)+H2O(g)?CO2(g)+H2(g)
开始 1 1 0 0
转化 0.5 0.5 0.5 0.5
平衡 0.5 0.5 0.5 0.5
A.该温度下平衡常数K=$\frac{\frac{0.5}{V}×\frac{0.5}{V}}{\frac{0.5}{V}×\frac{0.5}{V}}$=1,故A正确;
B.平衡时通入CO气体,平衡正向移动,H2O的转化率增大.而CO的转化率减小,故B正确;
C.平衡时CO的体积分数为$\frac{0.5}{0.5+0.5+0.5+0.5}$×100%=25%,故C正确;
D.K与温度有关,与浓度、压强等无关,故D错误;
故选D.
点评 本题考查化学平衡的计算,为高频考点,把握平衡三段法、K的计算为解答的关键,侧重分析与计算能力的考查,注意K与温度的关系,题目难度不大.


科目:高中化学 来源: 题型:填空题
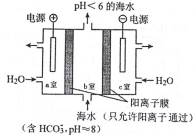 利用如图所示装置从海水中提取CO2,也有利于减少温室气体含量.
利用如图所示装置从海水中提取CO2,也有利于减少温室气体含量.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③②①⑤④ | B. | ①②③④⑤ | C. | ②③①④⑤ | D. | ③⑤②①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;当温度过高时,尾气中有毒气体的含量会升高,原因是CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO(用化学方程式表示).
;当温度过高时,尾气中有毒气体的含量会升高,原因是CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO(用化学方程式表示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 溶液X中一定含有Na+、Cl-和SiO32- | |
| B. | 溶液X中一定不含Ca2+、Br- | |
| C. | 为确定溶液X中是否含有SO42-,可取溶液2,加入BaCl2溶液 | |
| D. | 在溶液X中依次滴入盐酸、双氧水和硫氰化钾溶液后,溶液将变为红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取样,加少量AgNO3溶液,有白色沉淀;再加稀硝酸,看白色沉淀是否消失 | |
| B. | 取样,先加盐酸酸化,再加入AgNO3溶液,看是否有白色沉淀生成 | |
| C. | 取样,先加稀硫酸酸化,再加入AgNO3溶液,看是否有白色沉淀生成 | |
| D. | 取样,滴加AgNO3溶液,看是否有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | X、Y均能燃烧,都有大量浓烟产生 | |
| B. | X既能使酸性高锰酸钾溶液褪色,也能使溴水褪色,还能发生加聚反应 | |
| C. | X属于苯的同系物 | |
| D. | Y的二氯代物有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水的电离程度始终增大 | |
| B. | $\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$先增大再减小 | |
| C. | 当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO-),c(H+)=c(OH-) | |
| D. | 当加入氨水的体积为10mL时,溶液中的pH=7,由水电离出的c(H+)=1×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
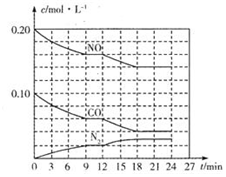 为有效控制雾霾,各地积极采取措施改善大气质量,有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.
为有效控制雾霾,各地积极采取措施改善大气质量,有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com