
下列叙述中,不正确的是( )
A.某特定反应的平衡常数仅是温度的函数
B.催化剂不能改变平衡常数的大小
C.平衡常数发生变化,化学平衡必定发生移动达到新的平衡
D.化学平衡发生移动,平衡常数必发生变化
 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:
(1)在反应2KMnO4+16HBr===5Br2+2MnBr2+2KBr+8H2O中,还原剂是___▲___还原产物是___▲____。
(2) 该反应中,发生氧化反应的过程是___▲____→___▲____。
(3) 若有0.1 mol KMn04 参加反应,则转移电子的物质的量为 ___▲____mol, 被氧化的HBr的物质的量为 ___▲____ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是
A.NH4HCO3溶于过量的NaOH溶液中:
HCO +OH-===CO
+OH-===CO +H2O
+H2O
B.醋酸溶液与水垢中的CaCO3反应:
CaCO3+2H+===Ca2++H2O+CO2↑
C.向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO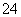 恰好完全沉淀:
恰好完全沉淀:
2Al3++3SO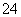 +3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
D.向NaAlO2溶液中通入过量CO2:
AlO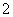 +CO2+2H2O===Al(OH)3↓+HCO
+CO2+2H2O===Al(OH)3↓+HCO
查看答案和解析>>
科目:高中化学 来源: 题型:
PVDC是世界上目前唯一大工业化生产、可以承受高温蒸煮、具有高阻隔性能的塑料,可作为保鲜食品的包装材料,用它作为中间层,制造多层复合材料,更是目前塑料包装行业技术进步和技术创新的前沿阵地。PVDC是聚偏二氯乙烯的英文缩写,它的结构简式是 。下列说法错误的是( )
。下列说法错误的是( )
A.PVDC是由单体CCl2===CH2发生加聚反应合成的
B.PVDC是由单体CCl3CH3发生缩聚反应合成的
C.PVDC也有很大的缺点,如在空气中熔融可分解,分解成为HCl、炭黑、水蒸气等,会污染空气
D.PVDC的单体可发生加成、取代、氧化、消去等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
乳酸CHCH3OHCOOH是人体生理活动的一种代谢产物,以下是采用化学方法对乳酸进行加工处理的过程,其中A、H、G为链状高分子化合物

请回答下列问题:
(1)写出C、D的结构简式:C:________________;D:________________。
(2)从下述三个有机反应类型中选择② ⑥所属的类型(填代号):②________,⑥________。
A.取代反应 B.加成反应 C.消去反应
(3)写出下列反应的化学方程式
①_________________________________________________;
⑤_________________________________________________。
(4)作为隐形眼镜的制作材料,对其性能的要求除具有良好的光学性能外,还应具有良好的透气性和亲水性。一般采用E的聚合物G而不是D的聚合物H来制作隐形眼镜,其主要理由是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
高炉炼铁过程中发生的主要反应为
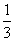 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g) 
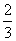 Fe(s)+CO2(g)。已知该反应在不同温度下的平衡常数如下:
Fe(s)+CO2(g)。已知该反应在不同温度下的平衡常数如下:
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式K=________,ΔH________0(填“>”、“<”或“=”);
(2)在一个容积为10 L的密闭容器中,1 000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)=________,CO的平衡转化率=________;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是________。
A.减少Fe的量 B.增加Fe2O3的量
C.移出部分CO2 D.提高反应温度
E.减小容器的容积 F.加入合适的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)  2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始、平衡时的有关数据如下表:
2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始、平衡时的有关数据如下表:
| 容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量:23.15 kJ |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是( )
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为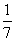
C.容器②中达平衡时放出的热量Q=23.15 kJ
D.若容器①体积为0.5 L,则平衡时放出的热量小于23.15 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸盐(K2FeO4、Na2FeO4)在能源、环保等方面有着广泛的用途。)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。干法、湿法制备高铁酸盐的原理如下表所示。
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色K2FeO4和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色Na2FeO4溶液 |
(1) 干法制备K2FeO4的化学方程式为Fe2O3+3KNO3+4KOH 2K2FeO4+3KNO2+2H2O,该反应中氧化剂与还原剂的物质的量之比为 。
2K2FeO4+3KNO2+2H2O,该反应中氧化剂与还原剂的物质的量之比为 。
(2)高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂。请完成FeO42-与水反应的方程式:4FeO42-+10H2O  4Fe(OH)3+8OH-+( )
4Fe(OH)3+8OH-+( )
(3)K2FeO4在处理水的过程中能消毒杀菌是因为① ,
它能净水的原因是② 。
(4) 工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
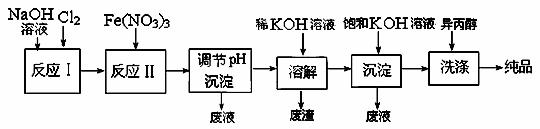
①反应I的化学方程式为 。
②反应II的离子方程式为 。
③加入饱和KOH溶液的目的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com