
分析 (1)依据“亚硝酸钠和氯化铵先反应生成氯化钠和亚硝酸铵”书写第一步化学反应方程式;依据“亚硝酸铵再受热分解生成氮气和水”书写第二步化学反应方程式;
(2)依据氧化还原反应得失电子守恒解答即可.
解答 解:(1)第一步的反应物为亚硝酸钠和氯化铵,生成物为氯化钠和亚硝酸铵,依据元素守恒配平,故化学反应方程式为:NaNO2+NH4Cl=NaCl+NH4NO2;
第二步的反应物为亚硝酸铵,生成物为氮气和水,依旧元素守恒配平,化学反应方程式为:NH4NO2=N2+2H2O,
故答案为:NaNO2+NH4Cl=NaCl+NH4NO2;NH4NO2=N2+2H2O;
(2)NH4NO2=N2+2H2O,此反应中,只有N元素的化合价发生变化,且亚硝酸中的N元素由+3价降低到0价,铵根中的N由-3价升高到0价,每有1mol亚硝酸铵分解,转移电子数为3mol,故答案为:3.
点评 本题主要考查的是质量守恒定律的应用以及氧化还原反应得失电子守恒,依据题给信息得出反应物与生成物是解决本题的关键,难度不大.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:多选题
| A. | 有两种同分异构体 | B. | 是非极性分子 | ||
| C. | 只有一种结构,无同分异构体 | D. | 是一种制冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
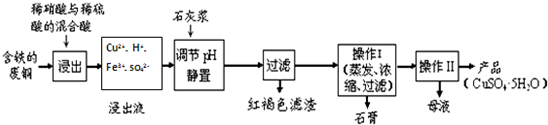
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
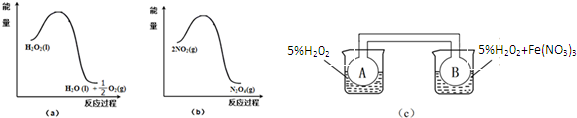
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
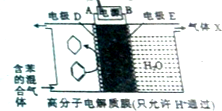
| A. | 电极D的电极反应式为C6H6+6H++6e-=C6H12 | |
| B. | 气体X在反应中通常体现还原性 | |
| C. | 电极D为惰性电极,E为活泼电极 | |
| D. | 外电路电子的移动方向:A→电源→B |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验装置 | 现象 |
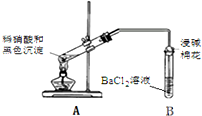 | 1.A试管中黑色沉淀逐渐溶解 2.A试管内上方出现红棕色气体 3.B试管中出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
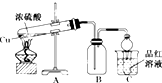 某化学兴趣小组为探索铜与浓硫酸的反应,用如图所示装置进行有关实验.
某化学兴趣小组为探索铜与浓硫酸的反应,用如图所示装置进行有关实验.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 第四周期IVA族 | B. | 第五周期IVA族 | C. | 第四周期VA族 | D. | 第五周期VA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.48L | B. | 5.6L | C. | 6.72L | D. | 13.44L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com