
 2AB3(g) △H<0,下列图像正确的是( )
2AB3(g) △H<0,下列图像正确的是( )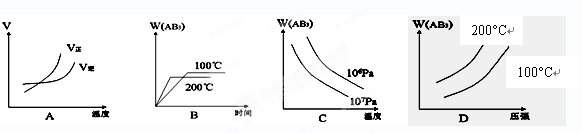
科目:高中化学 来源:不详 题型:填空题
 2NO+O2的反应。反应过程中NO2的物质的量随时间变化的状况如图所示。
2NO+O2的反应。反应过程中NO2的物质的量随时间变化的状况如图所示。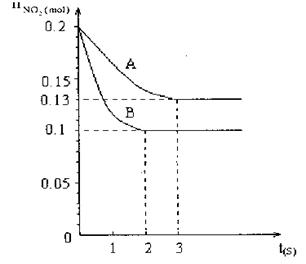
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
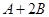
 C分别在三种不同实验条件下进行,它们的起始状态均为
C分别在三种不同实验条件下进行,它们的起始状态均为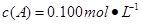 、
、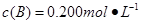 、
、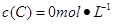 。在三种条件下,反应物A的浓度随时间的变化如图所示。下列说法中正确的是( )
。在三种条件下,反应物A的浓度随时间的变化如图所示。下列说法中正确的是( )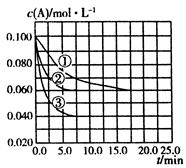
| A.反应的平衡常数:①<② |
B.反应A+2B C的 C的 |
| C.实验②平衡时B的转化率为60% |
D.实验③平衡时 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 4Fe(OH)3 + 8OH-+ 3O2,
4Fe(OH)3 + 8OH-+ 3O2,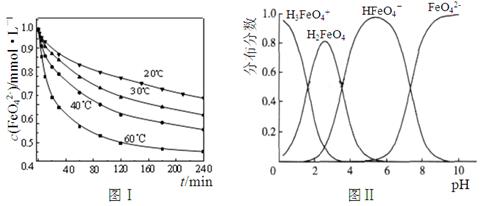
 H++FeO42-的电离平衡常数表达式为K=___________________,其数值接近 (填字母)。
H++FeO42-的电离平衡常数表达式为K=___________________,其数值接近 (填字母)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 3B(?)+C(?) △H>0达到化学平衡后,
3B(?)+C(?) △H>0达到化学平衡后,查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H2(g)+I2(g)△H>0,H2的物质的量随时间的变化如图示,下列说法正确有是
H2(g)+I2(g)△H>0,H2的物质的量随时间的变化如图示,下列说法正确有是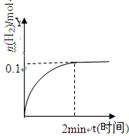
A.该温度下,反应的平衡常数是 |
| B.0~2min内的HI的平均反应速率为0.05mol·L-1·min-1 |
| C.恒压下向该体系中加入N2,平衡不移动,反应速率不变 |
| D.升高温度,平衡向正反应方向移动,只有正反应速率加快 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 pC(g)+qD(g)
pC(g)+qD(g)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.新制的氯水在光照条件下颜色变浅 |
| B.开启啤酒瓶后,瓶中立刻泛起大量泡沫 |
| C.高锰酸钾(KMnO4)溶液加水稀释后颜色变浅 |
| D.工业生产硫酸的过程中使用过量的空气以提高SO2的利用率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.混合物中各组分的浓度改变 | B.混合体系中气体密度发生变化 |
| C.正、逆反应速率改变 | D.反应物的转化率改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com