

| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
| △c |
| △t |
| 0.06mol/L |
| 0.1mol/L |
| c2(NO2) |
| c(N2O4) |
| 0.122 |
| 0.04 |
| 1 |
| 2 |
| 0.070mol/L-0.050mol/L |
| 40s-20s |


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某离子反应中涉及N2、H2O、ClO-、H+、NH4+、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如图.
某离子反应中涉及N2、H2O、ClO-、H+、NH4+、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如图.查看答案和解析>>
科目:高中化学 来源: 题型:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
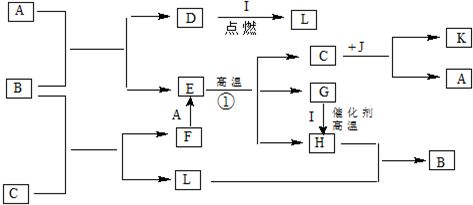
A、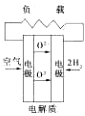 固化氧化物燃料电池 |
B、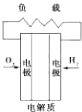 碱性氢氧化物电池 |
C、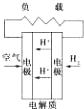 质子交换膜燃料电池 |
D、 熔融盐燃料电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、往容积一定的容器中再通入O2,可以加快反应2SO2+O2?2SO3的反应速率 |
| B、用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率 |
| C、对于C(s)+H2O(g)?CO(g)+H2(g)的反应,加入固体炭,反应速率加快 |
| D、100mL 2mol?L-1的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com